想减肥又怕伤肝?决明蒽酮来帮忙!Chin Med:决明蒽酮通过修复棕色脂肪线粒体,实现抗肥胖与护肝双赢
来源:生物谷原创 2025-04-14 10:49
研究发现,决明蒽酮可改善肥胖小鼠脂质积累,减轻肝脏炎症。其机制是通过修复棕色脂肪组织线粒体功能,抑制线粒体DNA从棕色脂肪组织向肝脏的转移,从而发挥抗肥胖和护肝作用。

在生活中,肥胖已成为一个愈发普遍且棘手的健康问题。世界卫生组织将其视为全球流行病,它常因新陈代谢异常,致使食物摄入与身体能量消耗失衡,进而引发全身脂肪过度堆积。肥胖不仅会导致体重失控增加,还与多种慢性疾病紧密相关,像心血管疾病、脂肪肝相关的代谢功能障碍、胰岛素抵抗以及糖尿病等。据预测,到2030年,全球57.8%的成年人口将超重或肥胖,这无疑给人类健康和经济带来巨大挑战。
近期,Chin Med刊载的一项研究Aurantio-obtusin improves obesity and protects hepatic inflammation by rescuing mitochondrial damage in overwhelmed brown adipose tissue揭示了决明蒽酮(Aurantio-obtusin,AO)在改善肥胖和保护肝脏炎症方面的重要作用。该研究为肥胖治疗提供了新的思路。

研究背景
肥胖常伴随慢性全身性炎症,给公共健康带来严峻挑战。棕色脂肪组织(Brown adipose tissue,BAT)在调节代谢方面意义重大,其释放的分子能调控其他器官的代谢表型。比如,BAT释放的成纤维细胞生长因子21和C-X-C基序趋化因子配体-14,可使白色脂肪组织(WAT)发生褐变。同时,肝脏在脂肪生成、糖异生和胆固醇代谢中发挥关键作用,BAT与肝脏之间存在复杂的相互调节关系。
此外,线粒体对于脂肪细胞活动至关重要,它参与β-氧化和ATP生成等关键代谢途径。在肥胖领域,受损的BAT线粒体是否会释放损伤物质加重肝损伤,以及AO能否逆转这一过程,此前尚不明确。AO是从决明子中提取的一种蒽醌成分,具有多种药理活性,在调节脂质代谢和肥胖相关疾病方面备受关注,但其调节BAT与肝脏之间病理生理联系及对BAT线粒体功能障碍的潜在影响,仍有待深入研究。
研究结果
1. AO增加BAT产热,缓解肥胖小鼠肝脏炎症:研究人员通过建立HFHS饮食诱导的肥胖小鼠模型,发现AO能显著抑制正常和肥胖小鼠体重增加,且不影响热量摄入。AO可促进BAT细胞增殖,增加BAT重量,减少WAT重量,并改善HFHS饮食小鼠的BAT白化、WAT脂质滴增大和肝脏脂肪变性。在急性冷应激实验中,AO处理组小鼠体温下降更慢,表明其促进了BAT产热。同时,AO显著降低了HFHS饮食诱导的血清和肝脏中相关脂质和转氨酶水平,缓解了肝脏中cGAS/STING通路的激活,减轻肝脏炎症。
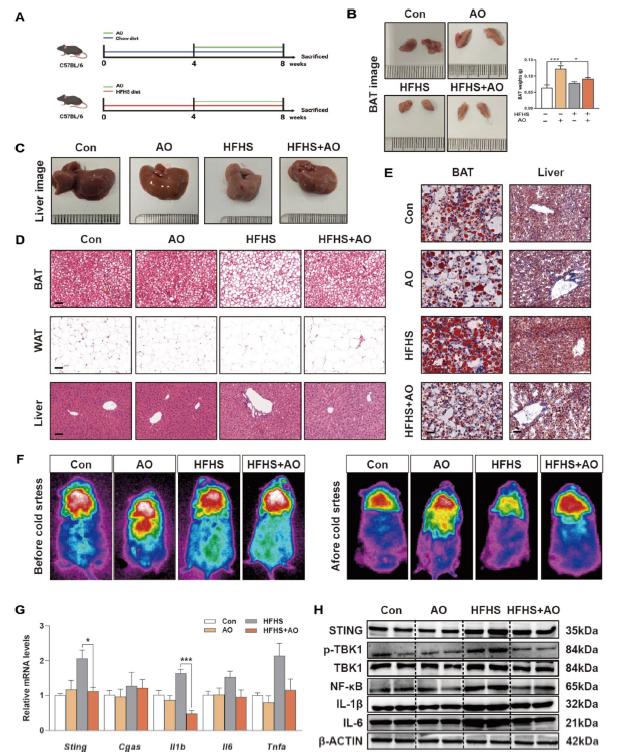
图 1:AO改善HFHS饮食喂养小鼠的BAT产热和肝脏炎症
2. 供体小鼠AO处理保护受体小鼠肝脏免受肥胖小鼠BAT诱导的炎症:研究表明,BAT切除会抑制AO对肝脏的保护和降脂作用。为进一步探究BAT与肝脏之间的病理细胞间通讯,研究人员将不同处理的BAT移植到受体小鼠体内。结果显示,移植肥胖小鼠的BAT会使正常饮食的受体小鼠肝脏出现炎症和轻微坏死,而移植AO处理的肥胖小鼠的BAT则可保护受体小鼠肝脏免受炎症侵害。移植AO处理的BAT的小鼠在冷应激后能维持更高体温,且肝脏中炎症相关基因和蛋白水平较低。
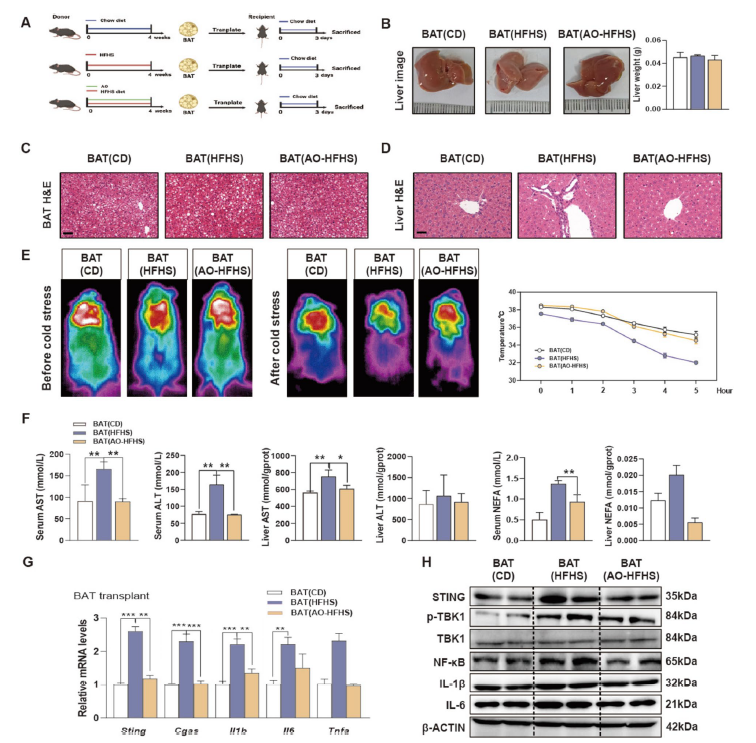
图 2:供体小鼠的AO处理保护正常饮食的受体小鼠免受肥胖小鼠来源的BAT诱导的肝脏炎症
3. AO处理的瘦小鼠BAT移植保护受体小鼠免受HFHS诱导的肥胖和肝脏炎症:将AO处理的正常饮食小鼠的BAT移植到HFHS饮食的受体小鼠体内,可一定程度降低受体小鼠体重,改善WAT中脂肪细胞的增大,保护肝脏免受空泡化和炎症细胞浸润。移植AO处理的BAT后,受体小鼠的肩胛间BAT皮肤温度和核心体温升高,血清和肝脏中的相关脂质和转氨酶水平下降,肝脏中炎症相关基因表达和cGAS-STING通路激活减少。而移植AO处理的WAT对受体小鼠的影响较小,这凸显了BAT在AO抗肥胖和护肝作用中的关键地位。
4. AO抑制BAT中过度氧化应激和mtDNA泄漏:对AO处理的BAT进行RNA测序分析发现,AO显著上调了脂质代谢和抗氧化应激相关基因的表达,下调了氧化应激相关基因的表达。在小鼠BAT组织中,AO增加了超氧化物歧化酶(SOD)水平,降低了丙二醛(MDA)和活性氧(ROS)水平。KEGG分析表明,AO处理后相关基因在氧化应激、脂肪酸代谢和线粒体相关途径中显著富集。此外,AO通过调节相关靶点,显著抑制了mtDNA的释放,降低了小鼠血清中的循环mtDNA水平。在体外建立的BAT细胞脂质积累模型中,也得到了类似结果,且AO可抑制线粒体通透性转换孔(mPTP)的开放。
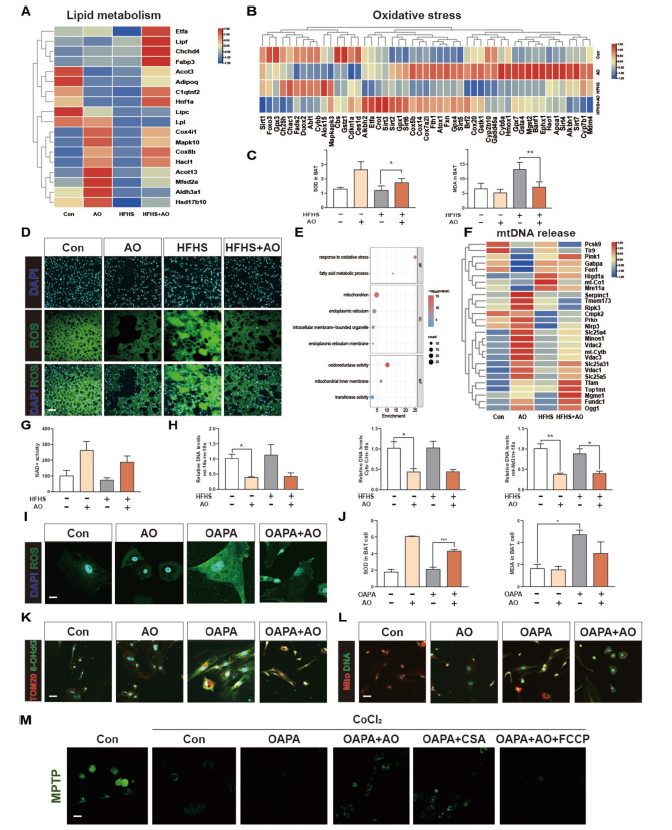
图 3:AO改善BAT中的氧化应激并减少mtDNA的释放
5. AO保护BAT,抑制释放含DNA的细胞外囊泡,改善STING依赖的肝脏炎症:研究发现,经油酸和棕榈酸(OAPA)处理的BAT细胞条件培养基(CM)可诱导AML12细胞炎症,而AO处理的BAT细胞CM则无此作用。用DNA酶处理OAPA处理的BAT细胞CM后,可消除其对肝细胞炎症STING信号的激活,证实BAT受高脂刺激后转移的是DNA(很可能是mtDNA)。通过使用细胞外囊泡(EVs)抑制剂GW4869发现,抑制BAT细胞中EVs的形成和分泌,可阻断OAPA处理的BAT细胞CM对肝脏STING通路的刺激和炎症反应。将不同处理的BAT细胞的EVs注射到小鼠体内,进一步验证了富含DNA的EVs可从BAT转移到肝脏,引发STING依赖的肝脏炎症,而AO或GW4869处理可抑制这一过程。在STING基因敲除小鼠中,注射富含DNA的EVs无法诱导肝脏炎症,再次证实了STING在BAT与肝脏通讯中的关键作用。
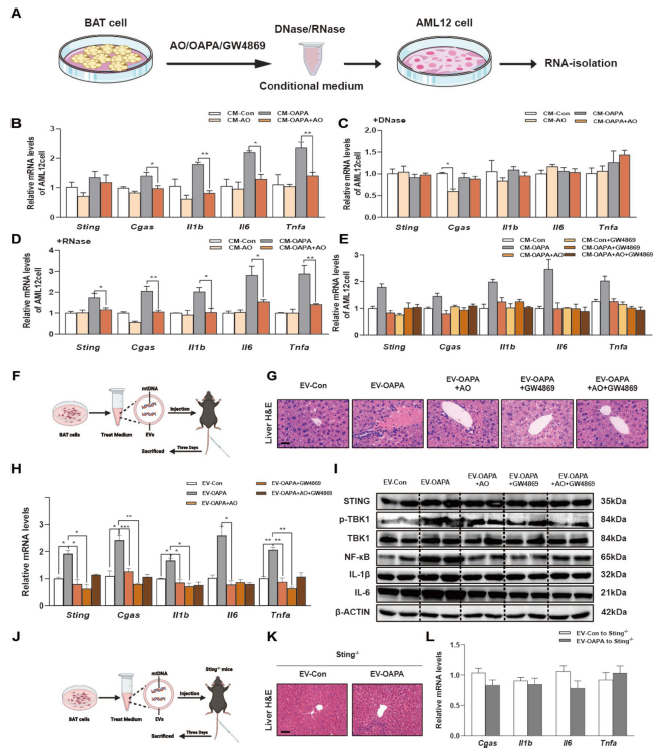
图4:AO保护过度负荷的BAT不释放富含DNA的细胞外囊泡,从而改善STING依赖的肝脏炎症
6. AO通过多种机制抑制mPTP开放,减少mtDNA释放:在氧化应激下,mtDNA可因线粒体膜电位(MMP)变化和mPTP开放而释放。AO显著抑制了HFHS饮食对PCSK9、SIRT3等相关基因转录和翻译的刺激作用,降低了PCSK9表达,促进了CypD的去乙酰化,抑制了mPTP开放相关基因的表达。同时,AO可促进PTEN诱导的假定激酶1(PINK1)/帕金森蛋白(parkin)介导的线粒体自噬,提高相关基因和蛋白水平,减少P62水平。此外,AO还抑制了电压依赖性阴离子通道1(VDAC1)的寡聚化,降低其mRNA和蛋白水平,促进其泛素化,从而保护线粒体稳态,抑制mtDNA释放。
小结
肥胖已成为全球性的健康难题,寻找安全有效的治疗方法迫在眉睫。这项研究表明,AO在改善肥胖和保护肝脏炎症方面展现出良好效果。它通过减少CypD乙酰化、促进线粒体自噬和抑制VDAC1寡聚化,抑制了mPTP的开放,减少了mtDNA从BAT释放到肝脏,进而减轻肝脏炎症。这一研究从BAT-肝脏轴的角度,为AO的抗肥胖机制提供了新见解,也为肥胖治疗提供了新的潜在方向,有望推动肥胖治疗领域的进一步发展,为众多肥胖患者带来新的希望。(生物谷Bioon.com)
参考文献:
Wu R, Liu R, Chen R, et al. Aurantio-obtusin improves obesity and protects hepatic inflammation by rescuing mitochondrial damage in overwhelmed brown adipose tissue. Chin Med. 2025;20(1):41. Published 2025 Mar 25. doi:10.1186/s13020-025-01097-y
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


