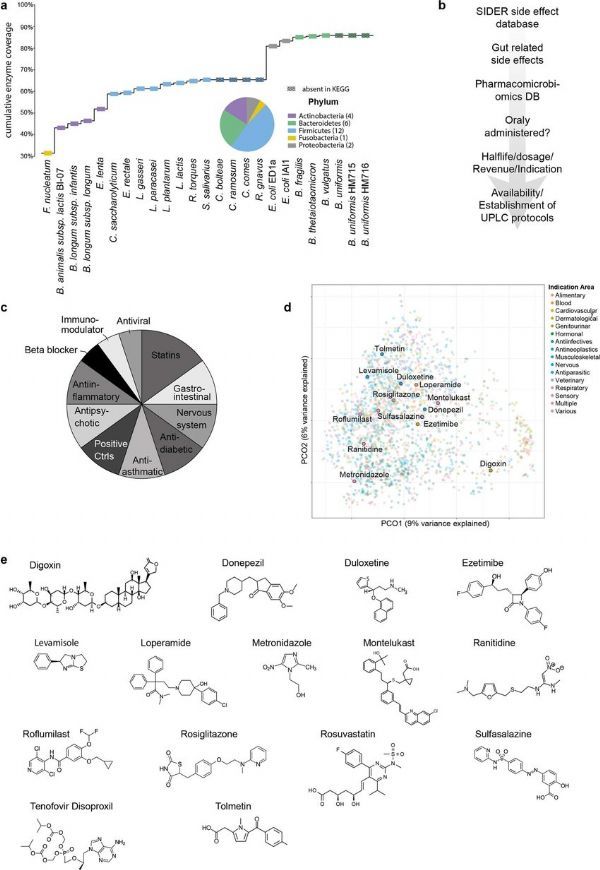
肠道微生物组研究进展(第10期)
来源:生物谷原创 2022-07-29 11:02
肠道是人体最大的消化和排毒器官,其回旋盘转的结构被形象地称为人体第二大脑。
肠道是人体最大的消化和排毒器官,其回旋盘转的结构被形象地称为人体第二大脑。肠道中寄生着数以计亿的细菌,它们是人体内最重要的一种外环境,各种微生物按一定比例组合,相互制约,相互依存,在质和量上形成一种生态平衡。然而肠道菌群并不都是人类的朋友,按特性来讲,它们可分为3大类,即好菌、坏菌和中性菌。当人体肠道中好菌比例下降而坏菌数量上升时,人体免疫力下降,极易导致多种疾病的发生。
研究表明,肠道菌群紊乱与多种疾病的发生密切相关,如消化系统疾病、内分泌系统疾病、精神系统疾病、自身免疫性疾病以及一些感染性疾病。基于此,小编针对肠道微生物组最新研究进展,进行一番梳理,以飨读者。
1.Science子刊:产生组胺的肠道菌群或会诱发机体的慢性腹痛
doi:10.1126/scitranslmed.abj1895
肠道菌群与慢性疼痛疾病的发生相关,包括肠易激综合征(IBS),但其背后的特殊病理生理学机制目前研究人员并不清楚。近日,一篇发表在国际杂志Science Translational Medicine上题为“Histamine production by the gut microbiota induces visceral hyperalgesia through histamine 4 receptor signaling in mice”的研究报告中,来自麦克马斯特大学等机构的科学家们通过研究发现,一种能够产生组胺(histamine)的肠道菌群“超级生产者”或会引发某些IBS患者出现疼痛发作。
其罪魁祸首或许就是称之为MQ菌株(McMaster-Queen菌株)的产气克雷伯菌,研究人员在来自IBS患者中高达25%的肠道菌群样本中都识别出了MQ菌株,同时他们还对来自加拿大和美国患者队列中的粪便微生物样本进行分析,研究者Premysl Bercik说道,我们对这些患者进行了多个月的追踪调查,结果发现,当患者报告机体出现严重疼痛时,其粪便样本中的组胺水平较高,而在其没有出现疼痛症状时,其粪便中的组胺水平就表现地较低。
研究人员通过对携带来自IBS患者肠道菌群的无菌小鼠进行研究后发现,产气克雷伯菌或许就是关键的组胺制造者,同时他们还将来自健康志愿者体内的肠道菌群移植到无菌小鼠体内作为对照进行研究。研究表明,产气克雷伯菌能将膳食中的组胺酸(一种存在于动物和植物蛋白中的必要氨基酸)转化为介导疼痛发生的组胺。随后,细菌所产生的组胺就能通过组胺-4受体来激活机体肠道的免疫系统,该受体能将免疫肥大细胞吸引到肠道中,这些被激活的肥大细胞能产生更多的组胺和其它疼痛信号介导子,从而诱发炎症和疼痛。
2.Sci Immunol:IgA抗体或能结合机体中的特定肠道菌群
doi:10.1126/sciimmunol.abg3208
尽管免疫球蛋白A(IgA)是分泌的最丰富的免疫球蛋白亚型,但其对于个体自身肠道共生菌群的反应性模式仍然让科学家们难以捉摸,近日,一篇发表在国际杂志Science Immunology上题为“Immunoglobulin A antibody composition is sculpted to bind the self gut microbiome”的研究报告中,来自西奈山Icahn医学院等机构的科学家们通过研究发现,IgA抗体或许能结合小鼠体内相关肠道菌群的特定种类。
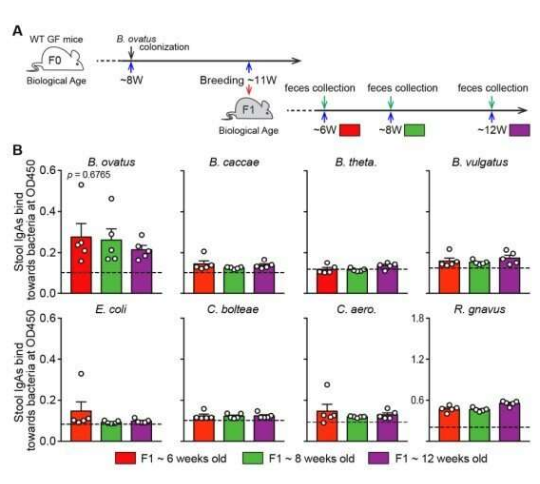
IgA抗体或能结合机体中的特定肠道菌群。图片来源:Science Immunology (2022). DOI: 10.1126/sciimmunol.abg3208。
此前研究结构表明,包括人类和小鼠在内的哺乳动物都会制造IgA抗体,而且IgA抗体能与肠道菌群结合来防止其被运输到机体的其它部位,从而引发疾病,然而目前研究人员并不清楚是否IgA抗体能以一种特殊的方式来靶向作用肠道菌群,或者是否其能够靶向作用特定的细菌。为了进一步研究IgA抗体如何发挥其作用,研究人员对多个受测试的小鼠机体的肠道进行了消毒,随后引入了8种细菌,并等待了3周时间,紧接着研究人员收集了受试小鼠的粪便样本,并对这些样本进行研究来确定其机体中的IgA抗体是如何与细菌进行结合的。
研究人员发现,IgA抗体仅能与单一的细菌群落结合,仅有少数例子会与同一个属的细菌交叉,他们注意到,有些甚至对单一细菌具有一定的特异性;这些研究结果表明,免疫系统或许能为正在存在的细菌产生定制化的IgA抗体。未来证实其研究发现,研究人员紧接着将相同的8种细菌引入到了无菌小鼠的肠道中,3周后,他们让小鼠产生咋交流细胞,即让B细胞与杂交瘤进行结合,研究者发现,杂交瘤细胞能产生21种独特的IgA抗体,除了两种之外其余IgA都能靶向作用单一的细菌群落,而且其中还有两种IgA能与所有8种细菌结合,研究者给予小鼠喂食杂交瘤细胞所产生的抗体,这些抗体能在胃部和肠道中存活,这或许就表明,相类似的疗法或能用来帮助人类患者解决肠道问题。
doi:10.1038/s41586-022-04949-x
肠道微生物既与良好的健康有关,也与促进自身免疫性疾病、炎症性肠病、代谢综合征,甚至是神经精神疾病等疾病的产生有关。对这些不好影响的一个流行解释是所谓的“肠漏(leaky gut)”假说,即潜在的破坏性细菌逃出肠道,引发慢性炎症反应,从而导致多种疾病。但是,一个未解之谜是潜在的致病细菌如何能在健康人中存在几十年而没有明显的健康后果。
在一项新的研究中,耶鲁大学免疫生物学助理教授Noah Palm及其研究团队对这个谜团提出了新的见解。他们描述了肠道细菌如何随着时间的推移而进化,通过获得跨越肠道屏障的迁移能力而变得更具致病性,并在肠道以外的器官中持续存在,从而驱动慢性炎症和相关病症。相关研究结果于2022年7月13日在线发表在Nature期刊上,论文标题为“Within-host evolution of a gut pathobiont facilitates liver translocation”。
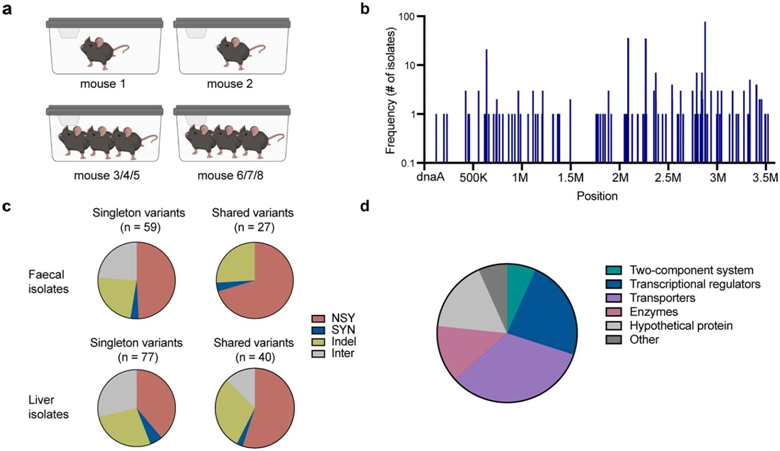
在单克隆定植的C57BL/6小鼠的鹑鸡肠球菌分离株中检测到突变。图片来自Nature, 2022, doi:10.1038/s41586-022-04949-x。
在这项新的研究中,Palm团队研究了一种潜在的致病细菌的遗传学和行为,他们将这种细菌植入缺乏自身肠道微生物的无菌小鼠中。随着时间的推移,他们发现这些细菌分化成两个不同的群体:一个与祖先菌株的行为相似,另一个获得了微小的DNA突变而使它们能够生活在肠道的粘膜内,并在逃离肠道后持续存在于淋巴结和肝脏中。
不像传统的病原体会促使免疫系统迅速清除,这些迁移的小菌群在器官中保持半隐蔽状态,可以避免免疫系统的注意---至少是暂时的。然而,这些作者发现,随着时间的推移,它们的存在最终会引发炎症性病变,如自身免疫性疾病。他们说,这种现象至少可以部分解释为何一些有潜在致病菌的人从不患病,但是为何患病风险随着年龄的增长而增加。
4.Gut:一种新型多肽通过抑制食欲和调节肠道微生物区系来预防肥胖
doi:10.1136/gutjnl-2022-32803
近日,来自中国科学院大学的研究者们在Gut杂志上发表了题为“A novel peptide protects against diet- induced obesity by suppressing appetite and modulating the gut microbiota”的文章,该研究结果表明,D3是一种无毒的生物活性多肽,是一种新的抗饮食诱导肥胖的候选药物。靶向UGN-GUCY2C内分泌轴可能是治疗肥胖症的一种治疗策略。
肥胖症流行及其代谢并发症仍然是一个重大的全球公共卫生威胁,有效的治疗方法有限,特别是可以口服的药物。多肽是一类很有前途的分子,由于其在医学和生物技术中的应用而受到越来越多的关注。在这项研究中,研究者重点寻找可以口服治疗肥胖症的多肽,并探讨其作用机制。
在本研究中,研究者设计了一种名为D3的9氨基酸多肽,并给无菌(GF)小鼠和野生型(WT)小鼠、大鼠和猕猴口服。评价D3对体重和其他基础代谢参数的影响。通过16S rRNA扩增序列测定,评价D3对肠道微生物区系的影响。为了鉴定和证实D3的作用机制,研究者在三种动物模型上进行了回肠转录组分析和分子生物学方法的研究。
用D3处理的WT(12%)和GF(9%)小鼠的体重都显著减轻。D3可改善瘦素抵抗,上调通过UGN-GUCY2C内分泌轴抑制食欲的UGN的表达。在饮食诱导的肥胖大鼠和猕猴模型中也发现了类似的影响。此外,D3处理后,肠道粘液阿克曼氏菌通过干扰素γ-irgm1轴的丰度增加了约100倍,这可能通过下调CD36来进一步抑制脂肪的吸收。
5.Cell Rep:科学家识别出有望治疗人类炎性肠病并预防结肠癌的潜在肠道菌群
doi:10.1016/j.celrep.2022.110646
近日,一篇发表在国际杂志Cell Reports上题为“Secreted NF-κB suppressive microbial metabolites modulate gut inflammation”的研究报告中,来自昆士兰大学等机构的科学家们通过研究分离了5种不同的肠道菌群,其或有望帮助研究人员开发新型疗法来治疗炎性肠病,并能潜在帮助预防某些形式的肠癌。
研究者Begun博士说道,尽管肠道微生物组由数以万亿计的细菌组成,且这些细菌随着时间的推移与人类一起不断进化,但在实验室的检测中,研究人员识别出的5种肠道菌群或能抑制炎性肠病患者的血液和组织样本中的炎症反应。 此外,其中的健康肠道菌群或许还能产生抗炎性物质,从而就能通过抑制一种主要的炎性分子调节子NF-kB来在临床前模型中降低疾病的严重性,且不引起任何副作用。
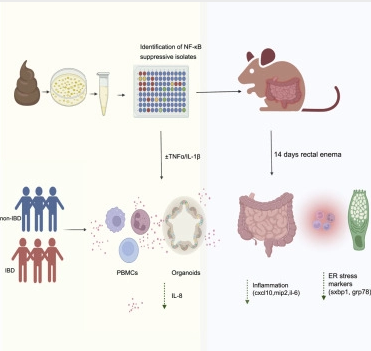
科学家识别出有望治疗人类炎性肠病并预防结肠癌的潜在肠道菌群。图片来源:Cell Reports (2022). DOI: 10.1016/j.celrep.2022.110646。
本文研究发现,良好的细菌菌种或能将促炎性酶类NF-kB的活性抑制大约一半,重要的是,这就足以抑制机体炎症且并不会在动物模型中引起任何的副作用。本文研究结果或为治疗炎性肠病的新型疗法奠定一定的基础,这种新型疗法或许是基于良好的肠道菌群所产生的天然物质,其安全性要比现有的药物更加安全。目前在澳大利亚有超过10万人都患有炎性肠病,炎性肠病主要由两种亚型,即克罗恩病和溃疡性结肠炎。
6.Cell:新发现!肠道菌群或能开发膳食纤维来为宿主机体释放有益的营养物质!
doi:10.1016/j.cell.2022.06.004
由非苛刻的食品加工方法所产生的副产品流中的植物性纤维或能代表多样化、天然存在的且具有生理活性的生物分子生物库;近日,一篇发表在国际杂志Cell上题为“Microbial liberation of N-methylserotonin from orange fiber in gnotobiotic mice and humans”的研究报告中,来自华盛顿大学等机构的科学家们通过研究发现,特定的人类肠道微生物或能挖掘膳食纤维来提取营养物质,否则人类机体中将无法获得这些营养物质,文章中,研究人员阐明了诸如水果和蔬菜的果皮种子等食物生产中的纤维副产物或许会成为促进人类健康的有益生物分子的一种来源。
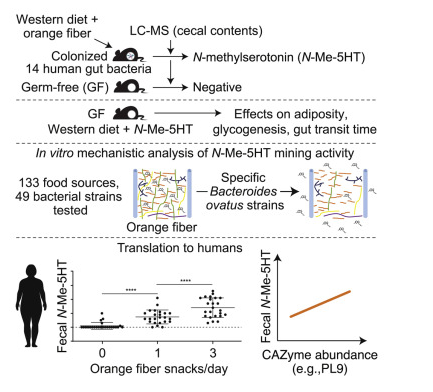
新发现!肠道菌群或能开发膳食纤维来为宿主机体释放有益的营养物质。图片来源:DOI: 10.1016/j.cell.2022.06.004
研究人员测试了49种不同类型的人类肠道菌群,并识别出了一种名为卵形拟杆菌(Bacteroides ovatus)的肠道菌群,其能有效利用来自橙子纤维中的N-甲基羟色胺,利用创新性的分子分析,研究人员表示,卵形拟杆菌或能产生人类基因中缺失的酶类,这种酶类的功能就好像分子剪刀一样能拆解将N-甲基羟色胺包裹在橙子纤维中的复杂的糖类结构。随后研究人员继续分析N-甲基羟色胺的生物学效应,当给予无菌小鼠时同时让其摄入不含有橙子纤维的美国高脂肪饮食时,N-甲基羟色胺或能减少宿主机体的脂肪储存,并改善其肝脏中的糖类代谢,且能产生更快速的肠道转运时间。
随后研究人员发现,其通过对小鼠进行的临床前研究中获得的结果或能转化到人类中,在一个雄性的临床试验中,他们发现,摄入含有橙子纤维零食的人群或许粪便样本中的N-甲基羟色胺水平会增加,这种效应或许是纤维特异性的,当摄入含有豌豆纤维的零食时或许就不会出现这种效应,此外,摄入含有橙子纤维的零食的同时,参与者机体肠道微生物组中存在的特定微生物基因的水平会明显增加,其或许会分解捕获橙子纤维中N-甲基羟色胺的多糖分子。
研究人员所使用的方法强调了微生物组科学、食品科学和营养学之间的关联,该研究强调了膳食纤维并不是一个实体而是很多个实体,同时研究人员提出了一个框架来确定能负担得起和可持续的纤维来源以及相关的营养物质,并能利用食物加工过程中的副产物,否则这些副产物将会被作为废物丢弃。目前科学家们对N-甲基羟色胺的了解相对较少,但其在结构上类似于血清素,而血清素是一种在机体情绪、睡眠和其它关键功能上扮演关键作用的神经递质;此外研究人员还确定,N-甲基羟色胺或许仅存在于极少数的纤维类型中,他们测试了130多种可食用的植物,包括诸如玉米、小麦和大米等主要食物类型,结果发现,仅在少数辣椒(但不是辣椒、甜椒或黑胡椒)中含有N-甲基羟色胺。
7.Nat Commun:揭示肠道微生物组组成可能影响konzo病易感性
doi:10.1038/s41467-021-25694-1
根据一项针对180名儿童的研究,来自刚果民主共和国(DRC)konzo病易发地区的人群肠道菌群和基因方面的差异可能会影响食用加工不良的木薯后的氰化物释放。木薯是发展中世界5亿多人的一种粮食安全作物。领导这项研究的美国国立儿童医院的研究人员表示,生活在高风险的Konzo地区的儿童在他们的肠道中有高表达葡糖苷酶(亚麻苦苷酶)的微生物和低表达硫氰酸酶的微生物,这可能意味着对这种疾病的易感性和保护性更低。相关研究结果于2021年9月10日发表在Nature Communications期刊上,论文标题为“The gut microbiome in konzo”。
konzo病是一种严重的、不可逆的神经系统疾病,会导致瘫痪。它发生在食用加工不良的木薯之后,其中木薯根是刚果民主共和国和其他低收入国家的基本作物。加工不良的木薯含有亚麻苦甙(linamarin),即一种生氰化合物。当具有葡糖苷酶活性的酶将淀粉转化为单糖时,它们也会分解亚麻苦甙,然后将氰化物释放到体内。
论文共同通讯作者、美国国立儿童医院遗传医学研究中心主任Eric Vilain博士说,“知道谁的风险更大,可能进行有针对性的干预,以更好地加工木薯或尝试使饮食多样化。另一种替代性的干预措施是改变肠道微生物组以提高保护水平。然而,这是一项艰难的任务,可能会产生意想不到的后果和其他副作用。”
8.Nutrients:植物性饮食方式或能让机体肠道微生物组更加健康!
doi:10.3390/nu13082638
近年来,越来越多的研究证据表明,植物性饮食能给机体带来多种健康益处;近日,一篇发表在国际杂志Nutrients上题为“Differential Effects of Western and Mediterranean-Type Diets on Gut Microbiota: A Metagenomics and Metabolomics approach”的研究报告中,来自巴塞罗那自治大学等机构的科学家们通过研究发现,改用植物性饮食的人群所经历的胃肠胀气的增加或许是机体更健康肠道微生物组的一个标志,文章中,研究人员描述了他们如何对健康男性志愿者进行有关饮食、粪便样本和胃肠胀气的相关研究。
众所周知,从以脂肪或碳水化合物为基础的饮食模式转向以更多蔬菜为特色的饮食方式或会导致机体产生更多的胀气(flatulence),尤其是转向以十字花科蔬菜为主的植物性饮食方式;但正如开展这项最新研究的工作人员所指出的那样,很少有研究能进一步深入分析饮食与胃肠胀气之间的关联。

植物性饮食方式或能让机体肠道微生物组更加健康!图片来源:Claudia Barber,et al. Nutrients (2021). DOI:10.3390/nu13082638
为了进一步研究改用植物性饮食对机体消化和肠道生物群的影响,研究人员招募了18名健康成年男性志愿者进行研究,每名参与者被要求先摄入西方饮食,随后转为以植物为基础的地中海饮食模式,研究持续两周时间。在研究期间,志愿者被要求计算他们每天排便的次数,同时研究人员对其粪便进行了采集和称量;同时志愿者还被要求计算其每天排出气体的次数,此外研究人员还对其进行随机测试,包括利用气球测定参与者胀气时所排出的气体量。
研究人员发现,饮食模式的改变并没有改变参与者每天排便的次数,但确实改变了其排出物质的数量;以植物为基础的饮食方式让其粪便的大小增加了一倍;这或许是由于参与者体内肠道菌群生长和排泄的质量大大增加的缘故;研究数据还显示,采用植物性的参与者每天胀气的次数增加了7次,而且每次大约能多排出50%的气体量,这或许是由于肠道中植物性食物材料的发酵所引起的。
9.Nature:重磅级发现!常见药物或能在人类机体肠道菌群中积累 或会降低药物的有效性且能改变肠道微生物组的功能!
doi:10.1038/s41586-021-03891-8
肠道中的细菌能帮助调节治疗性药物的可用性及疗效,然而研究人员最近才开始对药物和细菌之间相互作用进行系统性的分析,近日,一篇发表在国际杂志Nature上题为“Bioaccumulation of therapeutic drugs by human gut bacteria”的研究报告中,来自欧洲分子生物学实验室等机构的科学家们通过研究发现,普通的药物或能在肠道菌群中积累,从而改变细菌的功能并潜在降低药物的有效性,这种相互作用或能帮助更好地理解药物有效性和副作用的个体差异特性。
众所周知,细菌能化学性地修饰某些药物,这一过程被成为生物转化(biotransformation),这篇研究报告中,研究人员首次揭示了,特定的肠道菌群或能积累人类药物并改变细菌的类型及其活性。这或许会直接改变药物的有效性,因为药物在肠道菌群中的积累会降低机体对其可利用性,而且细菌的功能和组成的改变也与药物所产生的副作用有关。
细菌和药物选择。图片来源:Klünemann, M., et al.Nature (2021). doi:10.1038/s41586-021-03891-8
文章中,研究人员培养了25种常见的肠道细菌,并分析了其与15种口服药物之间是如何相互作用的,选择的药物能代表一系列不同类型的药物,包括抗抑郁药物等,众所周知,这些药物对个体的影响是不同的,其会产生一定的药物副作用,比如肠道问题和体重增加等。研究人员检测了15种药物中每种药物是如何与选定的细菌相互作用的,总共进行了375次细菌-药物测试;结果发现细菌和药物之间存在70种相互作用,其中29种相互作用此前并未研究过。
10.PNAS:特殊的肠道菌群肽类或参与人类1型糖尿病的发生
doi:10.1073/pnas.2120028119
在1型糖尿病中,机体会出现针对胰腺β细胞的免疫细胞,胰腺β细胞在胰岛素的产生和分泌过程中发挥着重要作用,这种免疫反应最早的目标之一就是胰岛素分子中的特定氨基酸序列(肽类序列),然而目前研究人员并不清楚诱发这种自身免疫性反应背后的分子机制。近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“A gut microbial peptide and molecular mimicry in the pathogenesis of type 1 diabetes”的研究报告中,来自波士顿学院等机构的科学家们通过研究识别出了一种特定类别的人类肠道细菌,其或能制造一种含有特殊氨基酸序列的蛋白,从而就能模拟1型糖尿病中被宿主机体免疫系统所靶向作用的胰岛素肽类,分析结果表明,靶向作用1型糖尿病中胰岛素肽类的免疫细胞或能与来自肠道菌群肽类的类似序列发生交叉反应,而且这种细菌的存在还能加速1型糖尿病小鼠模型糖尿病的发病。重要的是,进一步调查研究还揭示了肠道菌群的存在与具有遗传风险的1型糖尿病儿童患1型糖尿病之间的关联。
研究者C. Ronald Kahn指出,尽管遗传和家族史都会促进机体患1型糖尿病,但1型糖尿病在儿童中的发病率正在上升,其速度超过了仅以遗传为基础所能解释的观点,本文研究结果表明,暴露于类似于胰岛素肽类的细菌所产生的肽类中或许会刺激或增强开启1型糖尿病的自身免疫反应。文章中,研究人员分析了微生物数据库并识别出了47种微生物肽类或与能与在1型糖尿病中成为靶点的胰岛素肽类(即insB:9-23肽类)相匹配,其匹配度高达50%或以上,随后研究人员还合成了17种最相似的候选肽类分子,并检测其是否能激活在1型糖尿病出现的insB:9-23特异性免疫细胞,结果发现,仅有一种来自肠道菌群Parabacteriodes distasonis所产生的肽类能激活人类和小鼠针对insB:9-23肽类的特异性免疫细胞。
随后研究人员发现,将这种细菌给予携带1型糖尿病风险因素的小鼠或许会导致其胰腺胰岛素产生的胰岛细胞发生严重炎症,同时会使其糖尿病提前发作;对269名0-3岁的婴儿(具有易于患1型糖尿病的倾向)进行人类肠道微生物组分析后,研究者发现,早期肠道微生物组中有这种细菌的婴儿患1型糖尿病的风险要比没有携带这种细菌的婴儿高得多。综合来看,本文研究结果表明,正常肠道微生物组中的肽类或能模拟胰岛素肽类,同时其还能潜在诱发早期1型糖尿病开端或加剧疾病的进展,这一概念或许适用于其它自身免疫性疾病。(生物谷 Bioon.com)

会议推荐
2022年(第八届) 肠道微生态与健康国际研讨会
肠道微生态与人体健康密切相关,科研学者围绕肠道微生物与免疫系统、代谢性疾病、消化系统疾病、肿瘤、神经系统疾病、药物代谢等的关系展开大量研究,多组学、测序方法更新迭代、合成生物学、菌群移植、AI等技术的发展也为肠道研究带来了强大助力,肠道微生态的研究逐步向精细化和纵深化前行。
“生物谷”作为一直深耕生物医药领域领先的生物行业平台,将在上海举办2022年(第八届) 肠道微生态与健康国际研讨会。本次大会将由生物谷、上海第十人民医院、中科院上海巴斯德研究所联合主办。本次会议将继续秉承关注学术前沿、同时助推产业转化的优良传统,邀请科研院所知名专家学者、医院相关科室临床医生、产业代表、行业领军企业、监管机构与媒体等共同参与本次大会,同时集结技术、资本优势资源,凝聚产业发展向心力、共同推进肠道微生态研究的临床应用及产业转化。

版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。