BJC:肝癌或许也可以靠尿检!
来源:奇点糕 2022-02-17 12:35
肝细胞癌(HCC)是全球癌症相关死亡的主要原因之一,其预后取决于肿瘤的分期。早期HCC患者可通过切除或肝移植等方式进行治疗,其5年生存率>70%,而晚期患者5年生存率<10%,由此可见,早期诊断尤为重要。目前,HCC筛查普遍认可和使用的生物标志物是血清甲胎蛋白(AFP),然而其敏感性一般(40-60%),尤其是在筛查早期H
肝细胞癌(HCC)是全球癌症相关死亡的主要原因之一,其预后取决于肿瘤的分期。早期HCC患者可通过切除或肝移植等方式进行治疗,其5年生存率>70%,而晚期患者5年生存率<10%,由此可见,早期诊断尤为重要。
目前,HCC筛查普遍认可和使用的生物标志物是血清甲胎蛋白(AFP),然而其敏感性一般(40-60%),尤其是在筛查早期HCC时;且AFP升高还与病毒性肝炎患者的高ALT水平有关。为了改善早期HCC筛查方法,迫切需要开发更好的生物标志物。
近日,由美国Baruch S. Blumberg 研究所Ying-Hsiu Su领衔的研究团队在British Journal of Cancer期刊上发表重要研究成果。该团队开发了一种基于尿液ctDNA生物标记物的检测组,包括突变的TP53,甲基化的RASSF1A和GSTP1,并与AFP联合建立两阶段模型,用于HCC的检测和筛查。
相比单独使用AFP检测,含尿液ctDNA的两阶段模型检测能将检出病例数提高30%,巴塞罗那肝癌分期(BCLC)0期HCC的检出率从62%提高到92%, BCLC A期从40%提高到77%。因此,基于尿液ctDNA的检测对HCC患者,尤其是低AFP患者具有良好的诊断价值,可作为一种潜在的无创性HCC筛查方法。
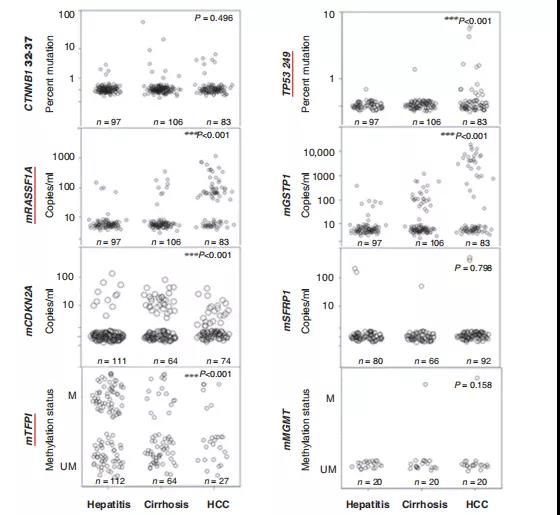
HCC是一种由多种病因引起的异质性疾病,因此会存在多种基因的改变。前期研究表明,尿液中含有一些低分子量DNA或无细胞DNA[5];另外HCC等癌症患者尿液中的DNA也具有癌症特异性,如基因突变和异常DNA甲基化等[6]。
为了确定HCC的潜在尿液DNA标记物,研究人员利用来自慢性肝病、肝硬化或HCC患者的已保存尿液DNA,对8种标记物进行检测,发现与非HCC(肝炎+肝硬化)患者相比,HCC患者尿液中249位点突变TP53、甲基化的mRASSF1A和mGSTP1水平显着增高,因此将这3个标记物作为ctDNA检测组用于后续分析。
接下来,研究者开展了一项前瞻性、多中心病例对照式分析,共入组609例患者,包括186例HCC,144例肝硬化和279例乙型肝炎,收集其尿液DNA样本(至少1 ng/mL),并对尿液ctDNA检测组进行定量,以分析其筛查HCC的性能。
首先,研究人员通过构建ROC曲线,分析血清AFP和尿液ctDNA检测组对HCC的筛查性能。结果显示:虽然尿液ctDNA检测组的性能(AUROC为0.7440)不及血清AFP(AUROC为0.8546),但在90%特异性时,血清AFP的诊断临界值为5.8 ng/mL,明显低于普遍接受的AFP值≥20 ng/mL [7]。
考虑到肝硬化和慢性肝炎患者的AFP通常高于5.8 ng/mL[8],研究人员将AFP <20 ng/ml的患者定义为“低AFP”,进一步分析尿液ctDNA检测组在低AFP患者中的检测性能。
研究人员发现在186例HCC患者中,98例(53%)为低AFP患者,这一比率与以往研究一致[8]。另外,当特异性为90%时,在所有HCC患者中,82例(44.1%)患者尿液ctDNA检测呈阳性;而在低AFP患者中,48例患者尿液ctDNA阳性。该数据表明尿液ctDNA标记物的检测性能独立于血清AFP。
为了更好的从低AFP人群中鉴别HCC患者,研究人员提出以AFP≥20 ng/mL为临界值鉴别HCC的两阶段模型,然后在低AFP的亚群上建立AFP和ctDNA联合的logistic模型。结果显示:两阶段模型AUROC为0.9118,显着高于仅使用AFP的模型;该模型在特异性为90%时,可以从低AFP人群中额外鉴别出60例(60%)HCC患者。
接下来,研究人员按肿瘤分期(BCLC分期),进一步分析了AFP、尿液ctDNA和两阶段模型在肿瘤不同分期中的总体表现性能。
结果显示:以AFP≥20 ng/mL为临界值,仅使用AFP对BCLC分期0、A、B、C和D期患者检测的敏感性分别为62%、40%、57%、52%和29%;当尿液ctDNA检测特异性为90%时,结果分别为23%、49%、39%、43%和71%;而两阶段模型的敏感性显着提高,分别为92%、77%、78%、81%和86%。
由于早期检测是筛查试验的关键,研究人员进一步将注意力集中在BCLC 0和A期HCC上。分析表明,虽然尿液ctDNA检测对BCLC 0期的筛查敏感性较低,但所有样本的AFP均<20 ng/mL,因此两阶段模型可将敏感性提高到92%;同样,在BCLC A期中,两阶段模型敏感性从40%提高到77%。
最后,研究人员利用十倍交叉验证来检验模型预测的稳健性。结果表明,两阶段模型是稳健的,其AUROC从训练集0.912降至验证集0.902,且在90%特异性下,其敏感性仅损失1%,从79.6%降至78.6%,无显着差异。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


