eLife:揭示TCR信号调控核孔复合物组装的新机制
来源:中山大学 2021-07-03 19:29
T细胞受体TCR信号是调控T细胞免疫的决定性因素。TCR信号通过一系列精准调控的级联转导,激活并诱导关键转录因子AP-1, NFκB及NFAT的核转位,从而活化T细胞,产生T细胞免疫效应。关于TCR信号如何经蛋白激酶PKCθ激活 AP-1一直是令人困惑的问题。揭开谜底,将帮助我们深入认识TCR信号的调控机制,并为更有效的免疫治疗提供新视角。核孔复合物(NPC
T细胞受体TCR信号是调控T细胞免疫的决定性因素。TCR信号通过一系列精准调控的级联转导,激活并诱导关键转录因子AP-1, NFκB及NFAT的核转位,从而活化T细胞,产生T细胞免疫效应。关于TCR信号如何经蛋白激酶PKCθ激活 AP-1一直是令人困惑的问题。揭开谜底,将帮助我们深入认识TCR信号的调控机制,并为更有效的免疫治疗提供新视角。
核孔复合物(NPC)是跨核膜分布的蛋白复合物,它是目前已知的负责真核细胞核质双向运输唯一且具有选择性的通道。其中,NPC的RanBP2亚复合物(RanBP2/RanGAP1-SUMO1/Ubc9)在形成跨核膜RanGTP浓度梯度及重装转运蛋白importin α/β入核复合物等中具有重要作用。通常认为,核孔复合物自主地介导细胞受体信号激活的转录因子入核,而对受体信号在调节核孔复合物中的作用知之甚少。
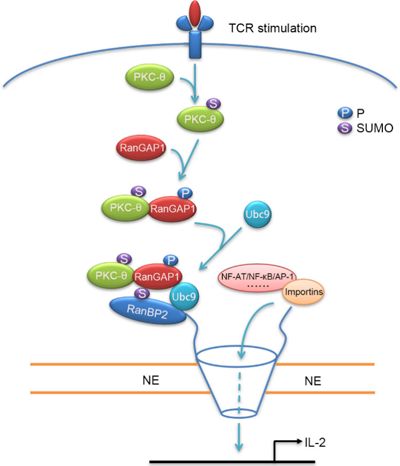
近日,中山大学生命科学学院李迎秋课题组研究首次揭示,人或鼠T细胞受到TCR信号刺激后,蛋白激酶PKC-θ直接磷酸化蛋白分子RanGAP1,促进RanBP2亚复合物组装及入核转运,从而引起AP-1的核转位。研究发现,TCR信号刺激诱导PKC-θ与NPC发生共定位并磷酸化RanGAP1, 而将RanGAP1上的磷酸化位点突变成非磷酸化位点,则抑制TCR信号诱导的关键转录因子核转位。究其原因,发现PKC-θ磷酸化RanGAP1增强其与SUMO化修饰中的缀合酶Ubc9结合,进而增强其SUMO化修饰,促进RanBP2亚复合物的组装(见示意图)。
综上,这项研究发现了TCR信号经PKC-θ调节NPC的RanBP2亚复合物组装,从而间接调控关键转录因子AP-1等的核转位,解开了蛋白激酶PKCθ如何调节AP-1转录活性之谜。研究结果首次建立了免疫受体信号与核孔复合物组装之间的直接联系,揭示了TCR信号调控的新层面,为受体信号及核质转运相关领域的研究及应用提供了重要参考。
研究成果“T-cell receptor (TCR) signaling promotes the assembly of RanBP2/RanGAP1-SUMO1/Ubc9 nuclear pore subcomplex via PKC-θ-mediated phosphorylation of RanGAP1”近日在国际知名学术期刊eLife在线发表。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


