Nature子刊:柴人杰团队等揭示GPR156在维持听觉功能中的激活机制
来源:生物世界 2024-12-21 10:24
该研究强调了GPR156在维持听觉功能中的作用,对我们进一步理解C类GPCR在结构和功能上的多样性具有重要意义。
近日,东南大学生命健康高等研究院/东南大学附属中大医院柴人杰教授团队联合浙江大学张岩教授、毛春友研究员及华中科技大学刘剑锋教授,在 Nature 子刊 Nature Communications 上发表了题为:Molecular insights into the activation mechanism of GPR156 in maintaining auditory function 的研究论文。
该研究揭示了听觉关键蛋白GPR156的组成性活性是如何通过二聚化来维持的,并解析了GPR156在维持听觉功能中持续激活的分子机制。

传统C类GPCR具有严格的二聚体的特征和能识别小分子配体的大胞外区域,然而,GPR156是极为特殊的一种,其序列上缺乏传统的大胞外区域,因此其二聚体的结构组成和激活机制可能不同于已知的其他C类受体。
该研究首先在体内通过AAV技术对内耳毛细胞中的GPR156进行了敲低,从而证明了GPR156不仅在听力的建立中发挥作用,在听力成熟后也能够持续激活以维持正常的听力功能。
为了阐明GPR156持续发挥作用的分子基础,研究团队使用冷冻电镜技术解析了载脂蛋白状态和激活状态的GPR156高分辨结构。首先,通过结构分析,研究发现GPR156仅通过ECL2和短N端形成较小的细胞外区域的新二聚体形式。之后,通过结合功能实验,研究进一步揭示了C类GPCR新的激活机制。在G蛋白偶联之前,GPR156采用对称的二聚体状态,两个亚基具有几乎相同的构象,并且具有相同的与G蛋白偶联的能力,类似于处于黄灯的等待状态。
当G蛋白偶联开始时,二聚体界面处没有发生重排,二聚体的TMD没有明显的旋转或平移,这时推测靠近G蛋白的GPR156亚基的C端与G蛋白相互作用。当G蛋白偶联后,结合G蛋白的亚基的C端平行于二聚体的胞内端;一方面,这有利于该亚基与G蛋白的结合,使其处于类似于绿灯的放行状态;另一方面,它占据了另一个亚基的TMD底部,阻碍了过量G蛋白结合引起的干扰,使其处于类似于红灯的关闭状态。这种机制可使GPR156下游G蛋白信号维持在稳定的水平。
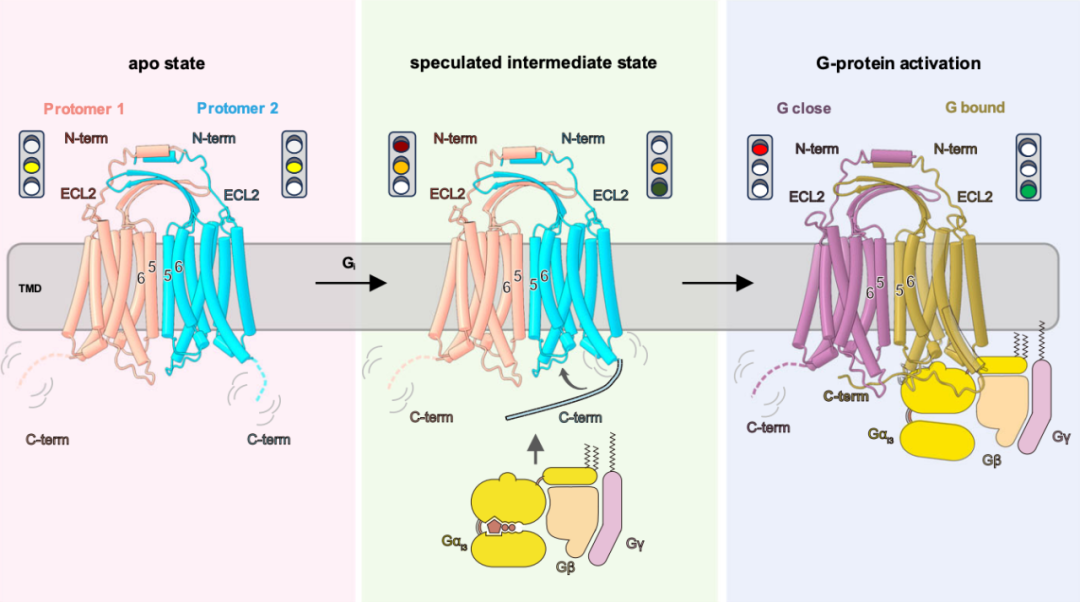
GPR156同源二聚体激活模式
该研究强调了GPR156在维持听觉功能中的作用,对我们进一步理解C类GPCR在结构和功能上的多样性具有重要意义。
东南大学柴人杰教授团队、浙江大学张岩教授团队、浙江大学毛春友研究员团队以及华中科技大学刘剑锋教授团队合作完成。柴人杰教授团队博士生马翔宇、浙江大学博士生陈礼楠、柴人杰教授团队博士后廖梦晖、博士后张李燕、硕士生郭佳敏、浙江大学助研席昆博士为论文共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


