J NEUROINFLAMM:雷公藤红素通过直接结合HMGB1蛋白在脑缺血再灌注中发挥神经保护作用
来源:生物谷 2021-09-01 16:09
几个世纪以来,雷公藤(TwHF)相关的方剂在我国广泛用于治疗自身免疫性疾病、肿瘤和其他疾病,在从雷公藤中分离出的众多生物活性成分中,雷公藤红素(cel)因其潜在的药用特性而受到密切关注。
几个世纪以来,雷公藤(TwHF)相关的方剂在我国广泛用于治疗自身免疫性疾病、肿瘤和其他疾病,在从雷公藤中分离出的众多生物活性成分中,雷公藤红素(cel)因其潜在的药用特性而受到密切关注。
许多研究表明,cel通过其抗氧化活性和神经炎症衰减能力在神经退行性疾病中具有神经保护作用,此外,cel通过促进小胶质细胞/巨噬细胞M2极化,降低磷酸化c-Jun氨基末端激酶(p-JNK)、磷酸化c-Jun(p-c-Jun)和核因子κB(NF-κB)的表达,以及抑制高迁移率族蛋白B1(HMGB1),显著地缓解短暂性全脑缺血和永久性脑缺血引起的损伤。(HMGB1)/NF-κB信号通路在大鼠中表现出抗炎和抗氧化作用,然而,很少有研究关注确定cel是否对脑缺血再灌注(I/R)损伤具有神经保护作用或确定其特异性结合蛋白靶标。
图片来源:https://doi.org/10.1186/s12974-021-02216-w
神经炎症过程涉及脑I/R损伤多个阶段的病理生理学,靶向神经炎症一直是治疗中风的有力的策略,对HMGB1(中风的关键促炎警报素之一)在炎症相关疾病中的深入研究已经进行了多年。HMGB1被激活的免疫细胞转移到细胞质和细胞外空间或者被坏死或受损的细胞被动释放,由于不同的翻译后修饰和激活的炎症免疫反应,它显示出动态的氧化还原状态;在细胞外,HMGB1作为损伤相关分子模式(DAMP)或警报通过受体介导炎症,包括晚期糖基化终产物受体(RAGE)和Toll样受体2、4 (TLR2、TLR4)。该研究在基于小分子化合物探针和化学标记的定量化学蛋白质组学技术的帮助下阐明了细胞在脑I/R损伤中的神经保护机制和靶点,并揭示cel直接结合HMGB1使其细胞因子活性失活,靶向热休克蛋白70(HSP70)和NF-κB发挥抗炎活性。
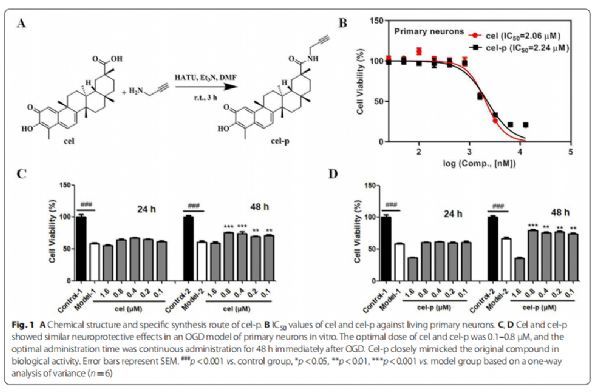
Cel和cel-p在体外表现出相似的神经保护作用 图片来源:https://doi.org/10.1186/s12974-021-02216-w
Cel-p是合成的,在cel的羧基末端带有一个炔基。研究者首先在活的原代神经元中检测到cel和cel-p的细胞毒性,根据半数最大抑制浓度(IC50)结果表明cel-p在生物活性方面与原始化合物非常相似(cel:IC50=2.06±0.52μM, cel-p:IC50=2.24±0.59μM)。对于细胞活力测定,原代神经元在96孔板中培养7天然后在糖氧剥夺(OGD)模型中培养,以评估cel和cel-p的神经保护作用,结果表明cel在原代神经元OGD模型中表现出明显的神经保护作用,cel的最佳剂量为0.1-0.8 μM,最佳给药时间为OGD后即刻连续给药48h。在该模型中Cel-p显示出与cel相似的神经保护作用,表明cel在引入双正交反应基团后保留了其生物活性。
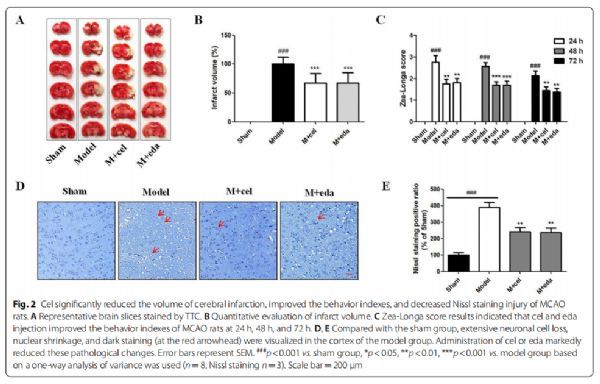
Cel显著减少大脑中动脉闭塞(MCAO)大鼠脑梗死体积,改善行为指标,减轻尼氏(Nissl)染色损伤 图片来源:https://doi.org/10.1186/s12974-021-02216-w
该研究评估了cel是否对大鼠脑I/R损伤表现出神经保护作用,2, 3, 5-三苯基氯化四唑(TTC)染色和定量分析结果表明,与模型组相比,cel和eda(依达拉奉,为自由基清除剂)显著降低了梗死体积(p<0.001)。根据Zea-Longa评分结果发现,cel和eda在24 h、48 h和72 h的行为指标均有显著改善(p<0.001),而模型组的神经功能未见明显改善,此外,Nissl染色结果表明,与模型组相比,cel和eda处理减少了MCAO大鼠皮质的病理变化。这些数据表明cel的神经保护作用在体内似乎与eda相似。
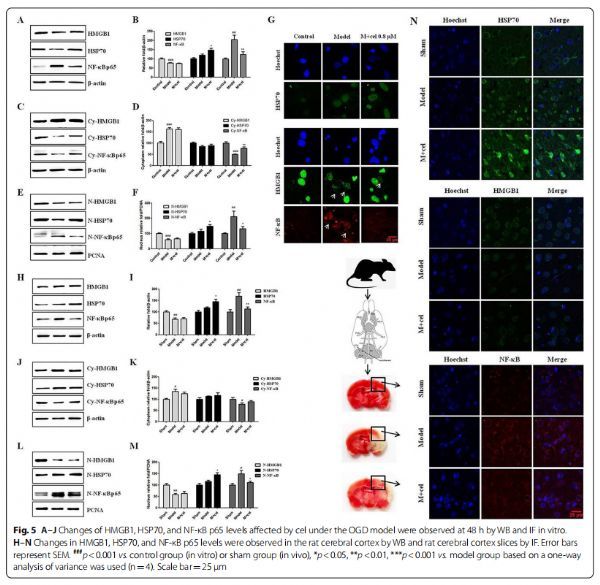
Cel通过HSP70和人核转录因子肽(NF-κBp65)发挥神经保护作用 图片来源:https://doi.org/10.1186/s12974-021-02216-w
先前的研究表明,cel诱导HSP70反应并抑制NF-κB活化以抑制炎症反应并调节先天免疫反应。因此,研究者建立了体外OGD模型和体内MCAO模型以模拟脑I/R损伤,并测试细胞是否影响细胞质和细胞核中HMGB1的分布变化以及HSP70和NF-κBp65蛋白的表达变化,结果表明模型和M+cel组细胞质中HMGB1的表达显著增加,而细胞核中HMGB1的表达显著降低,但整体HMGB1表达几乎不受cel影响,这对OGD损伤48h后HMGB1在细胞质和细胞核中的分布影响有限。相比之下,cel显著增加了HSP70的整体表达和核表达,并降低了NF-κB p65的整体表达和核表达,这与之前的研究结果一致。研究者发现免疫荧光(IF)结果与体外蛋白质免疫印迹(WB)结果一致,并且在MCAO大鼠中也观察到类似的WB和IF结果,与模型组相比,cel(1 mg/kg)显著上调HSP70的表达,下调NF-κB p65的表达,对MCAO模型大鼠HMGB1的表达无影响。这些结果表明cel通过增加HSP70的表达和降低NF-κB p65的表达发挥神经保护作用。
尽管cel及其众多衍生物对多种疾病表现出潜在的治疗作用,但由于其毒性作用、溶解度低和治疗剂量范围窄,均未获准用于临床。因此,确定一种解决细胞毒性并提高其疗效的方法代表了下一个研究方向,此外,越来越多的证据支持炎症在中风的不同阶段发挥着不同的作用,HMGB1根据其氧化还原修饰表现出不同的活性并且可能在缺血性中风中发挥更复杂的作用,但这仍有待探索。除了细胞因子活性外,HMGB1还在轴突再生、内皮激活、血管生成、神经血管修复和重塑中发挥有益作用,因此需要慎重考虑在脑卒中的不同阶段是否促进或抑制HMGB1。(生物谷 bioon)
参考文献:
Dan-Dan Liu et al. Celastrol exerts a neuroprotective efect by directly binding to HMGB1 protein in cerebral ischemia–reperfusion. JOURNAL OF NEUROINFLAMMATION (2021 Aug 09) doi:https://doi.org/10.1186/s12974-021-02216-w
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。