Adv Sci丨浙江大学朱成梁/蒋莉/曹戟揭示其在巨噬细胞中去乙酰酶非依赖性促炎功能
来源:生物探索 2024-08-04 10:38
在这项研究中,发现了HDAC7以前未被探索的、不依赖去乙酰化酶的促炎作用,并报道了第一个体内有效的HDAC7特异性降解剂B4。
浙江大学朱成梁、蒋莉及曹戟共同通讯在Advanced Science 在线发表题为“PROTAC-Mediated HDAC7 Protein Degradation Unveils Its Deacetylase-Independent Proinflammatory Function in Macrophages”的研究论文,该研究中,开发了一种基于PROTAC的新型化合物B4,它选择性地靶向和降解HDAC7,从而有效减弱脂多糖(LPS)刺激的巨噬细胞和小鼠模型中的一组特定促炎细胞因子。
通过使用B4作为分子探针,发现了先前探索的HDAC7作用超越其去乙酰化酶功能的证据,表明其在炎症过程中具有更广泛的意义。机制研究表明,HDAC7通过直接与TNF受体相关因子6和TGFβ活化激酶1(TRAF6-TAK1)复合物相互作用,在Toll样受体4(TLR4)信号通路中发挥关键作用,从而启动下游丝裂原活化蛋白激酶/核因子-κB(MAPK/NF-κB)信号级联的激活以及随后的基因转录。这项研究拓展了对HDAC7在复杂炎症网络中的作用的洞察,并强调了其作为抗炎治疗新靶点的治疗潜力。

细胞因子是免疫细胞分泌的必需化学信使,可协调正常的免疫反应。通过与细胞受体相互作用,细胞因子激活下游信号级联,引发免疫反应,保护身体免受炎症或感染。因此,维持促炎和抗炎细胞因子的动态平衡对于免疫稳态至关重要。相反,失调的细胞因子产生会破坏这种平衡,导致免疫紊乱,例如自身免疫性疾病,其特征是免疫系统错误地攻击身体自身的组织。大量研究表明,自身免疫性疾病通常伴有过度的巨噬细胞活化和促炎细胞因子释放。因此,失调的细胞因子网络被认为是导致这些疾病的主要因素。
然而,由于复杂的免疫网络涉及多种难以解决的信号通路和蛋白质,因此了解自身免疫性疾病的发病机制仍然具有挑战性。此外,虽然针对细胞因子及其受体提供了一种治疗免疫介导炎症疾病的方法,但抑制这些靶标可能会导致不良的副作用,因为许多细胞因子和受体具有多效性。因此,迫切需要开发针对细胞因子信号网络中关键分子节点的新型治疗策略。一种有希望的方法是针对控制细胞因子基因表达的表观遗传调节剂。表观遗传修饰,如组蛋白乙酰化和去乙酰化,在调节基因转录方面至关重要。通过调节表观遗传酶的活性,可能可以微调细胞因子的产生并恢复免疫平衡。
组蛋白去乙酰化酶(HDAC)是一种表观遗传酶,可催化组蛋白和非组蛋白上赖氨酸残基的N-ε-乙酰基修饰水解。通过这种去乙酰化活性,HDAC可以调节对免疫细胞分化、活化和代谢至关重要的基因转录。迄今为止,已鉴定出11种锌依赖性HDAC,并分为四个亚类:I类(HDAC1、2、3、8)、IIa类(HDAC4、5、7、9)、IIb类(HDAC6、10)和IV类(HDAC11)。文献和之前的研究表明,HDAC是炎症和免疫的重要调节剂。IIa类HDAC以其相当弱的脱乙酰酶活性而著称,这归因于其催化域内活性酪氨酸突变为组氨酸。与主要位于细胞核中的I类HDAC不同,IIa类HDAC在细胞核和细胞质之间穿梭,除了染色质修饰外,还参与各种细胞活动。
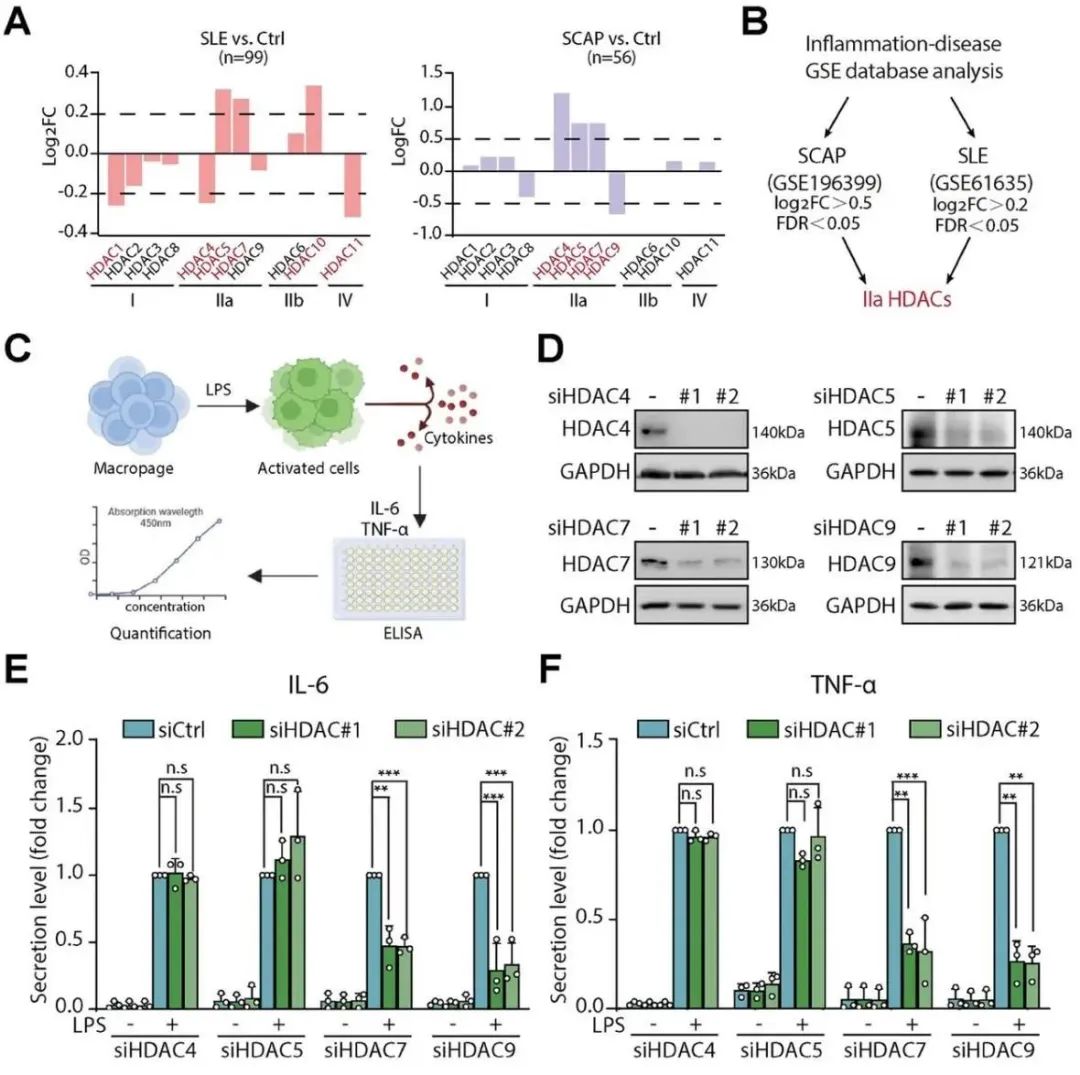
HDAC7敲低可显著减弱LPS刺激的巨噬细胞中的促炎细胞因子产生(Credit: Advanced Science)
具体而言,IIa类HDAC具有较大的非催化区域,可充当表观遗传读取器或伪酶,与多种细胞蛋白相互作用。IIa类HDAC的失调或过表达与许多疾病有关,包括代谢紊乱、炎症和癌症。尽管取得了重大进展,但由于当前抑制剂的全抑制作用以及用于研究其脱乙酰化以外的生物学功能的探针有限,对特定IIa类HDAC亚型的研究仍面临挑战。例如,IIa类HDAC的HDAC7在炎症巨噬细胞中上调,在细胞代谢和炎症中起关键作用。然而,其在调节炎症反应中的去乙酰化酶独立功能仍不清楚。
最近,蛋白水解靶向嵌合体(PROTAC)已成为一种利用细胞内源性蛋白酶体降解机制来破坏蛋白质功能的新方法。与传统的酶抑制相比,PROTAC介导的蛋白质降解具有几个吸引人的特性,包括持久的功效、增强的选择性以及针对酶和非酶活性的能力。因此,PROTAC方法在研究这些以前具有挑战性的目标方面显示出了巨大的前景。Fischer及其同事通过使用化学蛋白质组学方法探索HDAC的可降解性,进一步推进了这一领域,为开发针对IIa类HDAC的PROTAC提供了富有洞察力的指导。
在这项研究中,发现了HDAC7以前未被探索的、不依赖去乙酰化酶的促炎作用,并报道了第一个体内有效的HDAC7特异性降解剂B4。PROTAC化合物B4可有效诱导HDAC7降解,并显著减少脂多糖(LPS)刺激的巨噬细胞和小鼠模型中多种促炎细胞因子的分泌。使用B4作为分子探针,剖析了HDAC7在维持TNF受体相关因子6和TGFβ激活激酶1(TRAF6-TAK1)复合物和调节细胞因子基因转录中的非酶功能。研究强调了HDAC7在Toll样受体4(TLR4)信号通路中的重要作用,并提出使用异构体选择性降解剂靶向HDAC7作为治疗细胞因子介导的自身炎症疾病的潜在治疗方法。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


