Trends in Immunology:解码多层随机抗病毒IFN-I反应的动力学
来源:生物谷 2021-08-20 11:29
I型干扰素(IFN-I)反应最初被认为是在抗病毒免疫中起作用,但现在IFN-I被普遍认为具有多种免疫调节功能,如抗肿瘤反应、自身免疫表现和抗菌防御。鉴于这些关键作用,在体外、离体和体内病毒感染后,却只有一小部分细胞开始产生IFN-I。该研究强调需要创新的单细胞技术与数学模型相结合,以进一步揭示、理解和预测IFN-I系统在生理和病理条件下可能与多种疾病有关的复
I型干扰素(IFN-I)反应最初被认为是在抗病毒免疫中起作用,但现在IFN-I被普遍认为具有多种免疫调节功能,如抗肿瘤反应、自身免疫表现和抗菌防御。鉴于这些关键作用,在体外、离体和体内病毒感染后,却只有一小部分细胞开始产生IFN-I。这些第一反应者的部分,被称为“早熟细胞”或“早期反应细胞”,被认为是由全有或全无的细胞决策产生的,这种现象已在各种促炎细胞因子中观察到。IFN-I能通过旁分泌信号来激活周围细胞,以在病毒识别后增强IFN-I的产生,这一过程由大量的细胞第二反应者发起,这会导致产生第二次更强烈的IFN-I。而大多数细胞会被旁分泌信号感染和(或)激活,但不会在感染过程中或炎症的原因而产生IFN-Is,被称为无反应者。
图片来源:https://doi.org/10.1016/j.it.2021.07.004
近年来,数学模型的建立为抗病毒IFN-I反应的随机性提供了重要的见解,而本文对其进行了批判性评估。该研究强调需要创新的单细胞技术与数学模型相结合,以进一步揭示、理解和预测IFN-I系统在生理和病理条件下可能与多种疾病有关的复杂性,并且简要概述了由病毒诱导的信号产生的多层随机性,它是如何导致细胞异质性、如何决定上述三种细胞的命运以及数学模型如何帮助解释、理解和预测结果。该研究认为这些模型可以作为揭示和理解IFN-I信号通路复杂性的有力工具,其方式可能超过抗病毒免疫反应的知识。
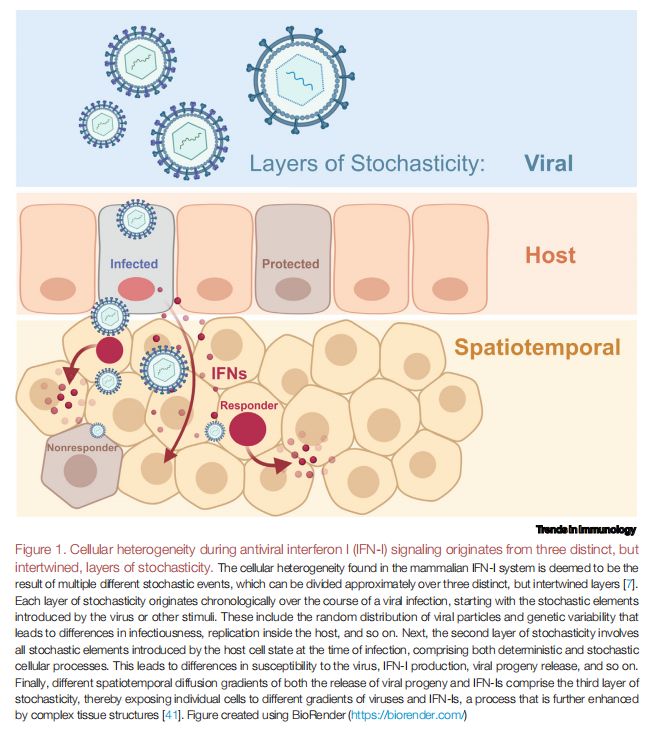
抗病毒干扰素I (IFN-I)信号传导过程中的细胞异质性源自三个不同但相互交织的随机层 图片来源:https://doi.org/10.1016/j.it.2021.07.004
IFN-I系统中的细胞异质性被认为是多个不同随机事件的结果,大致分为三个不同但相互交织的层。每一层的随机性都是在病毒感染过程中按时间顺序产生的,涉及不同的生物学、生化和生物物理过程。因此,这三层的随机性会导致在感染开始时间、病毒载量、IFN-I表达、IFN-I信号传导、抗病毒反应等方面的细胞结果大相径庭,甚至在第一批细胞被感染之前,第一层的随机性可能源于单个细胞所遇到的病毒颗粒的随机分布。此外,病毒群体内的遗传变异可能导致更多的变异,一些病毒颗粒或多或少能成功地建立感染,并且单个病毒颗粒在宿主体内的复制效率会发生变化,从而导致宿主细胞信号传导和随后分泌IFN-I的差异。
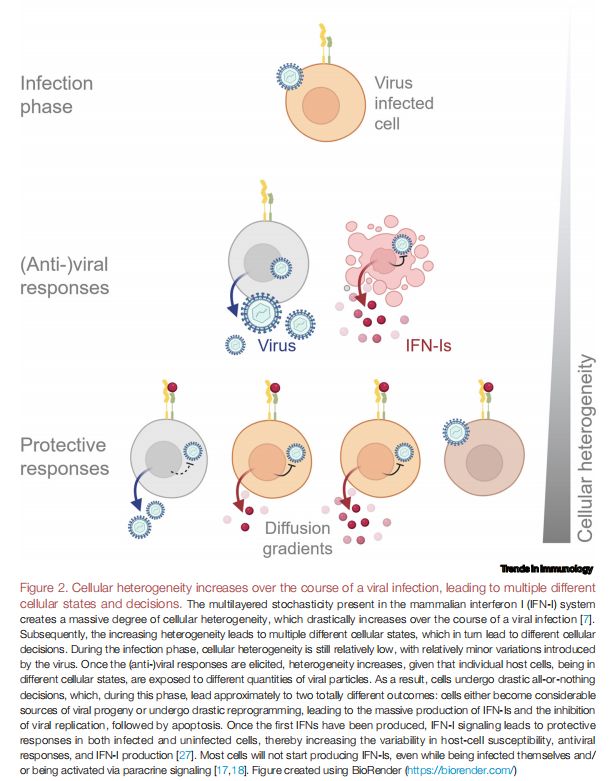
病毒感染过程中细胞异质性增加,导致多种不同的细胞状态和决定 图片来源:https://doi.org/10.1016/j.it.2021.07.004
与在细菌和酵母中发现的基因表达噪音不同,基因表达噪音会导致单个细胞的蛋白质含量在平均值附近波动,IFN-I反应的随机性(包括在IFN-I产生和IFN-I感知反应中观察到的异质性)可能会导致细胞启动或不启动IFN-I基因表达的全有或全无现象。有研究通过小鼠报告成纤维细胞的信号转导和基因表达动态的延时成像,证实了这种转换可以在不同的时间点发生。在不同的环境和物种中,这种全有或全无的决策在其他细胞因子中得到了更广泛的观察。不同类型的细胞因子和趋化因子,如IFN-β、CXCL10、CXCL11、CCL2和CCL5,往往在不同物种之间共同表达,包括人类、猕猴和小鼠,这些细胞因子的正、负调节因子都共同表达。这些发现表明,细胞因子的表达与干扰素的情况一样,是在单个细胞水平上受到严格控制。
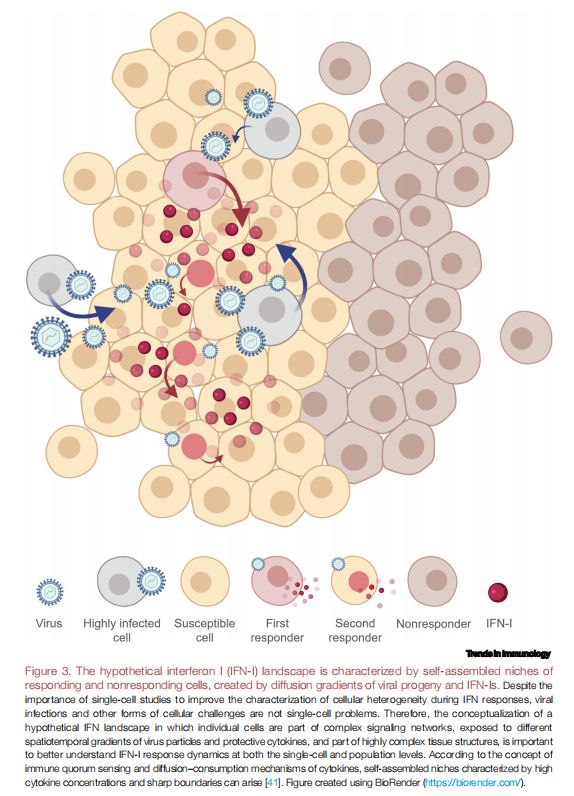
干扰素 I (IFN-I) 假说的特征在于应答和非应答细胞的自组装生态位,由病毒后代和IFN-Is的扩散梯度产生 图片来源:https://doi.org/10.1016/j.it.2021.07.004
与无应答者相比,尤其是在局部感染期间,许多细胞既不会感知病毒也不会感知产生的 IFN-Is。因此,另一种在体内对无应答者进行概念化的方法是通过研究免疫稳态,其目的是在时空上限制病毒复制和过量、潜在有害的IFN-Is。局部细胞竞争、空间限制和汇合限制被认为是影响免疫稳态的主要潜在因素,而免疫群体感应被广泛认为是一种促进免疫稳态的新的主要机制。从概念上讲,它涉及比旁分泌信号更大的群体水平的交流,如当单个细胞分泌和感知所谓的“免疫自体诱导剂”时,通常会发生干扰素浓度太低导致细胞无法响应。然而,一旦有足够多的细胞产生干扰素,就会相应地产生足够高浓度的此类自诱导剂,从而导致单个细胞中某些基因的激活或抑制并产生群体效应。此外,根据细胞因子传播的扩散消耗机制,细胞因子扩散和消耗之间的竞争可能会出现具有尖锐边界的高细胞因子浓度的空间自组装生态位。该研究认为,将免疫群体感应与IFN-I结合起来可产生一种新的关于IFN-I的假说,以IFN-I热点为特征对应应答细胞和非应答细胞的生态位,从而允许对IFN-I响应动态的严格调控。
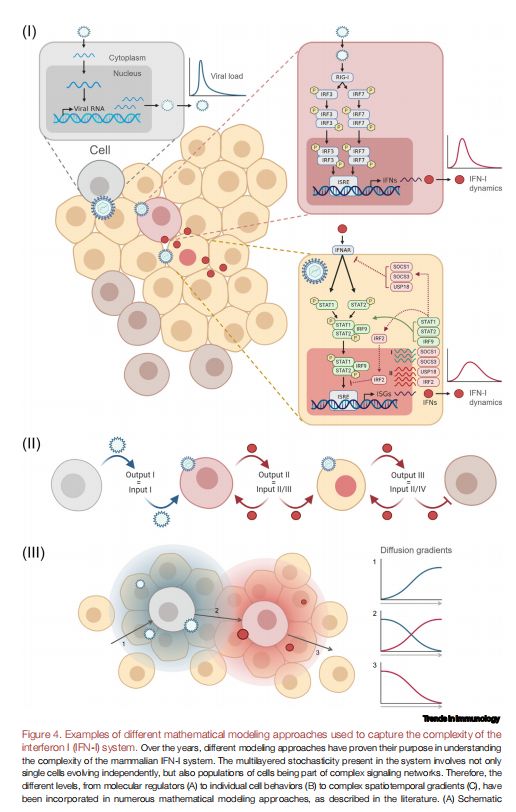
用于捕捉干扰素I (IFN-I)系统复杂性的不同数学建模方法的示例 图片来源:https://doi.org/10.1016/j.it.2021.07.004
IFN-I反应的多层随机性和时空动态为应用多种数学建模工具来了解其在群体水平和单个细胞内的调节提供了夯实的基础。自IFN-I建模开始以来,由多个微分方程组成的常微分方程(ODE)模型占据了该领域的主导地位,利用ODE框架研究病毒与宿主的相互作用有着丰富的经验,该框架跟踪三种物种的种群动态:靶细胞、感染细胞和病毒滴度。与随机或空间模型相比,ODE模型的简单结构在以下方面尤其有利:可用标准工具箱来模拟模型、将模型与数据相匹配、区分替代模型体系结构以及利用成熟的分析工具,如稳定性分析和敏感性分析,系统地研究细胞的动态行为。
几十年来,转录调节因子一直是研究IFN-I动力学的主要焦点,不同类型的细胞因子(如IFN-I、IFN-II和IFN-III)与细胞反应之间的相互作用越来越明显,从而为体内免疫结果增加了新的复杂性。解决这种复杂性的一种方法是结合数学模型对单细胞动力学进行解码,但随着IFN-I系统知识的提高,有助于解释和预测实验结果的数学模型,设计合理的实验方法加上可靠的数据解释和数学模型与实验数据的适当验证,将有必要继续揭示IFN-I系统在生理环境中的复杂性。
参考文献
Laura C. Van Eyndhoven et al. Decoding the dynamics of multilayered stochastic antiviral IFN-I responses. Trends in Immunology (2021 Aug 04) doi:https://doi.org/10.1016/j.it.2021.07.004
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



