Cell重磅:新型类病毒颗粒VLP递送系统,高效递送各种基因编辑工具,用于遗传疾病和癌症治疗
来源:生物世界 2025-04-13 11:53
该研究开发了一种高效且多功能的新型类病毒颗粒递送载体——ENVLPE,其能够将所有主要的 RNA 引导的基因编辑工具以 RNP 形式递送到多种细胞类型中。
德国慕尼黑工业大学的研究人员在国际顶尖学术期刊 Cell 上发表了题为:Engineered nucleocytosolic vehicles for loading of programmable editors 的研究论文。

基因编辑疗法的“最后一公里”难题
CRISPR-Cas9 基因编辑技术,以及新一代的碱基编辑器(Base Editor)、先导编辑器(Prime Editor),虽已成熟,但将其应用于疾病治疗时,传统的递送方法存在明显短板:
- 病毒载体:常用的慢病毒载体或腺相关病毒(AAV)载体存在整合风险,还可能引发免疫反应,且载体容量有限,难以装在碱基编辑器和先导编辑器;
- 脂质纳米颗粒(LNP):会向肝脏富集,通常难以靶向特定器官或细胞,且递送效率不足,导致基因编辑效率不稳定;
- 存在长期表达风险:递送(尤其是病毒载体递送的)的基因编辑工具在体内长期存在,可能导致脱靶效应。
在这项最新研究中,研究团队另辟蹊径,选择了类病毒颗粒(VLP,也叫做病毒样颗粒)——这是一类去除了病毒遗传物质的“空壳”,既能模拟病毒的感染能力,又避免了潜在的安全隐患。
优化的VLP——ENVLPE
类病毒颗粒(VLP)递送系统具有几个优势,能够利用具有不同嗜性的已知病毒的多样性来调节其对细胞或器官/组织的靶向性;VLP 还能够以核糖核蛋白(RNP)的形式封装和递送基因编辑器,不含有 DNA 成分,因此不会有插入突变的风险;此外,也不会因病毒成分或转基因成分的持续表达而激活宿主免疫应答。
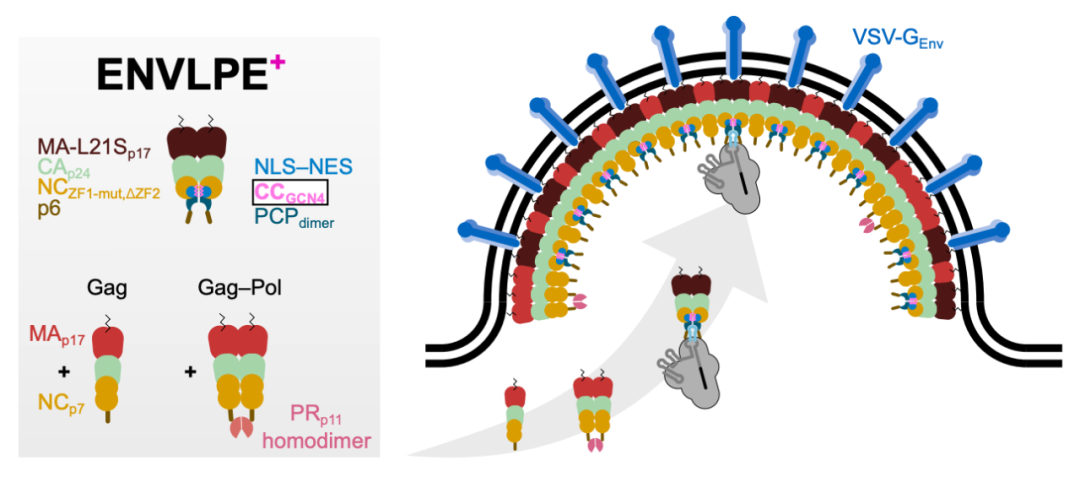
在这项研究中,研究团队开发了工程优化的 VLP——装载可编程编辑器的工程化核质运输载体(ENVLPE),通过引入 GCN4 蛋白,构建了效率更高的 ENVLPE+,其能够高效递送 mRNA、CRISPR-Cas9(包括CRISPRa、CRISPRi)、碱基编辑器(BE)以及先导编辑器(PE)。
1、智能导航系统:核质穿梭技术
传统的 VLP 只能在细胞质包装编辑工具,而基因编辑需要在细胞核中进行。研究团队在载体蛋白上安装了“核定位信号+核输出信号”,实现自主穿梭细胞核,将基因编辑器编辑直接打包运输。
2、精准抓取机制:PP7 适配体锁扣
通过基因工程在 gRNA 末端添加 PP7 适配体,就像给包裹贴上专属条形码。载体蛋白上的 PP7 结合域(PCP)能精准识别并抓取完整的 RNP ,确保只包装“装配完毕”的有效编辑工具。
3、防降解装甲:Csy4 蛋白护盾
针对先导编辑器中易降解的 pegRNA,研究团队引入细菌蛋白 Csy4。它能像“保护罩”般牢固结合 RNA 末端,实验结果显示,可使先导编辑效率提升 20 倍,成功解决了先导编辑效率不足这一长期技术痛点。
在体内和体外显示出卓越的编辑效果
在两种遗传性视网膜病变小鼠模型中,ENVLPE+ 系统递送的先导编辑器展现卓越效果:
rd6 模型(视网膜色素变性):单次注射后,关键蛋白 MFRP 表达恢复,电生理检测显示光信号响应提升 5.5 倍;
rd12 模型(莱伯氏先天性黑蒙症):成功修复 RPE65 基因突变,视网膜中 11-顺式视黄醛(视觉必需分子)恢复至正常水平的 20%。
此外,ENVLPE+ 系统递送的碱基编辑器在人类 T 细胞中实现双基因敲除(B2M + TRBC1/2),效率高达90%,为 CAR-T 细胞治疗提供了更安全高效的解决方案。
总的来说,该研究开发了一种高效且多功能的新型类病毒递送载体——ENVLPE,其能够将所有主要的 RNA 引导的基因编辑工具以 RNP 形式递送到多种细胞类型中,避免了 DNA 整合风险,并在人类原代 T 细胞以及两种遗传性视网膜疾病小鼠模型中展现了卓越的编辑效果,凸显了其治疗潜力。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


