谭蔚泓院士团队开发基于mRNA-LNP的体内原位CAR-M细胞疗法,增强癌症免疫治疗
来源:生物世界 2024-10-16 11:07
该研究开发了一种mRNA-LNP递送系统,用于体内靶向定制CAR-M的腹腔编程,并进一步加深了对CAR-M疗法治疗实体瘤的调控和反馈机制的理解.
近日,中国科学院杭州医学研究所谭蔚泓院士、谢斯滔研究员和刘湘圣研究员等在预印本平台 bioRxiv上发表了题为:Intraperitoneal programming of tailored CAR macrophages via mRNA-LNP to boost cancer immunotherapy 的研究论文。
该研究探索了36种包含不同巨噬细胞胞内域(ICD)的CAR组合,利用巨噬细胞靶向的
mRNA-LNP系统,实现了肿瘤免疫治疗所需的CAR-M细胞的体内原位高效构建。在实体瘤小鼠模型中,CAR-M细胞的腹腔内编程可引起稳健的适应性免疫系统激活,并且在耐药模型中与标准治疗PD-1/PD-L1免疫检查点阻疗法发挥显著的协同作用。

为了解决上述难题,研究人员开始尝试通过非病毒纳米载体在体内原位制备CAR-M细胞,直接治疗实体瘤。此外,目前对巨噬细胞的胞内域(ICD)的结构研究主要集中在CD3ζ信号转导上。然而,仅仅依赖CD3ζ并不能完全发挥巨噬细胞的多功能特性,用于肿瘤免疫疗法。因此,通过CAR途径系统性地研究与巨噬细胞相关的信号通路的合理设计、组合及其生物学效应是必要的。
在这项研究中,研究团队分析了含有不同胞内域(吞噬:CD3ζ和Dectin1;促炎:CD40和TLR4;可能效应物:CD46和CFS2R)的36种CAR组合对体外和体内巨噬细胞的生物学影响。
通过开发巨噬细胞靶向的mRNA-LNP递送系统,研究团队实现了肿瘤免疫治疗所需的CAR-M细胞的体内原位高效构建。
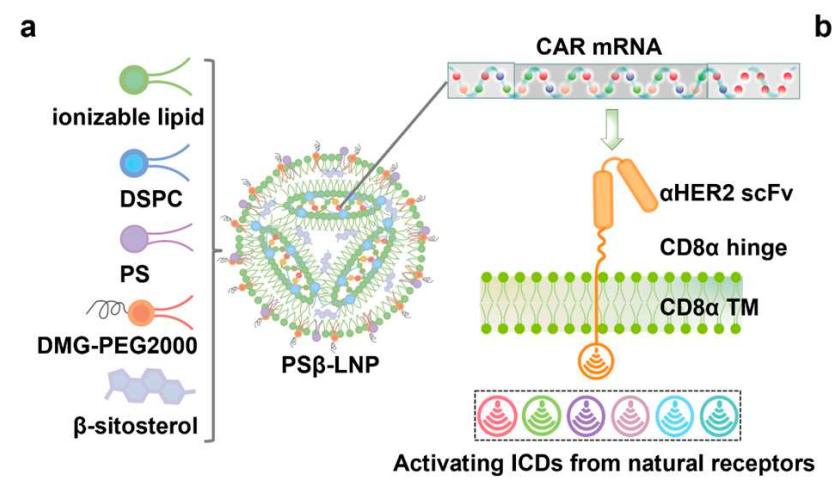
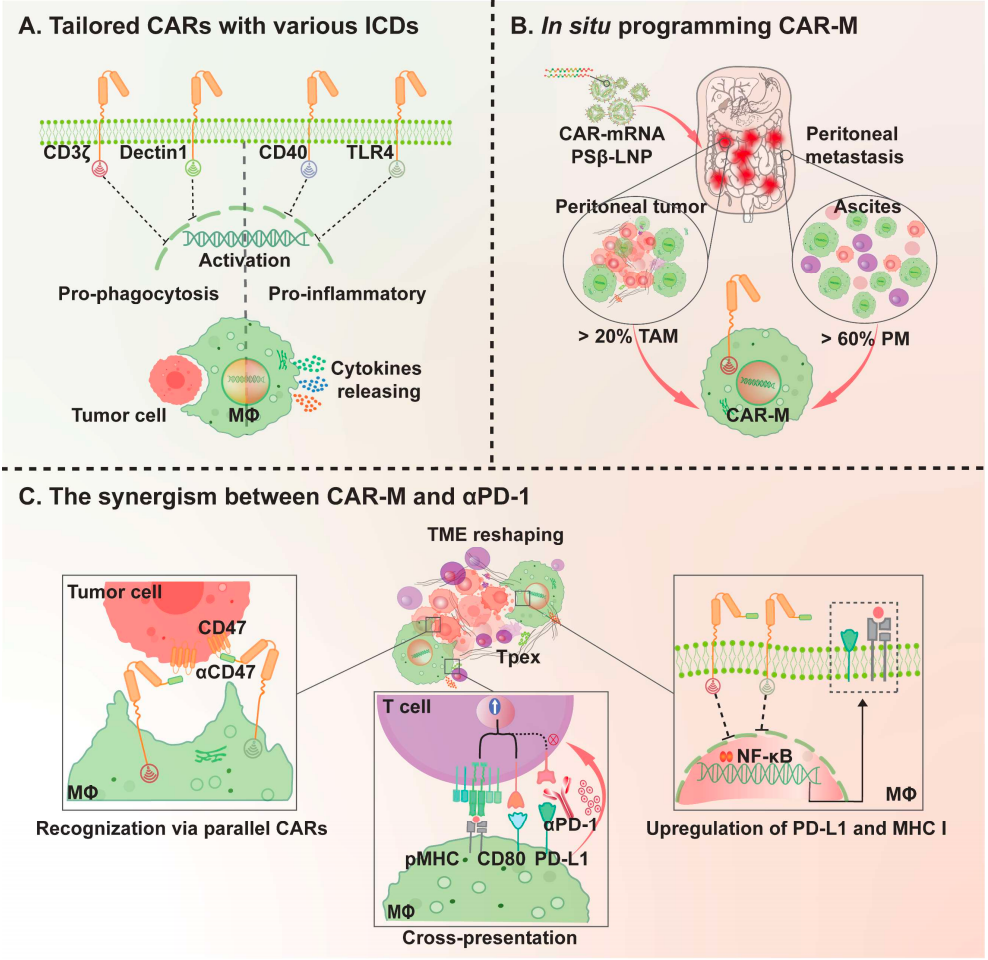
在两种同系实体瘤小鼠模型中,CAR-M腹腔内编程可引起稳健的适应性免疫系统激活,并且在耐药模型中与标准治疗PD-1/PD-L1免疫检查点阻疗法发挥显著的协同作用。通过全面的单细胞RNA测序(scRNA-seq)进一步分析表明,同时用CD3ζ和TLR4在体内编程CAR-M可以显著促进巨噬细胞从M2促癌表型向M1促炎表型的转变,通过干扰NF-κB通路以上调PD-L1和MHC I表达。同时,该研究还发现,CAR-M细胞重塑了免疫抑制性的肿瘤微环境,从而提高了TCF1+ PD-1+ 祖细胞耗竭的CD8 T细胞(Tpex)的数量。此外,siRNA介导的PD-L1敲低和CAR-M细胞之间的协同作用突出了巨噬细胞上PD-L1表达在抗原交叉呈递过程中的关键作用,强调了在抗原交叉呈递中阻断PD-1/PD-L1信号轴的必要性。
总的来说,该研究开发了一种mRNA-LNP递送系统,用于体内靶向定制CAR-M的腹腔编程,并进一步加深了对CAR-M疗法治疗实体瘤的调控和反馈机制的理解.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


