Immunity:肠道Tuft细胞分泌乙酰胆碱促进宿主排虫
来源:生物探索 2024-09-20 10:17
这两项研究均指出肠道Tuft细胞来源的乙酰胆碱在抗蠕虫感染中的重要作用:乙酰胆碱增强上皮细胞Cl-和液体分泌增强“weep”作用、降低虫体适应和繁殖能力,为Tuft细胞的生理作用提出新的见解。
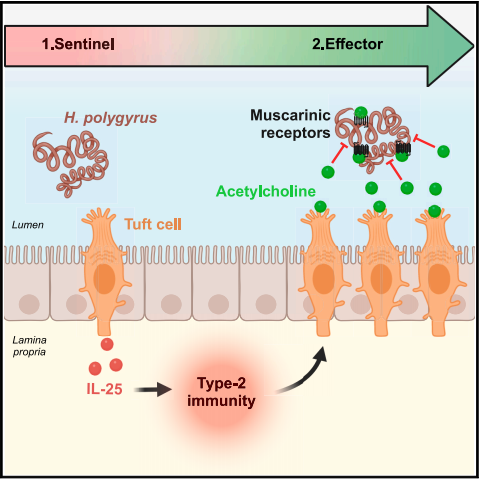
簇状(Tuft)细胞是一类主要存在于消化和呼吸系统上皮细胞中的细胞亚群,其在宿主黏膜稳态维持中具有重要作用。在肠道上皮中,Tuft细胞因其在寄生虫感染时起到重要的“哨兵”作用而被熟知。肠道中的寄生虫触发Tuft细胞分泌警报素白细胞介素-25(interleukin-25,IL-25),进而促进2型固有淋巴细胞(type 2 innate lymphoid cells,ILC2s)分泌2型细胞因子如IL-4、IL-5和IL-13,从而启动2型免疫应答【1-3】。IL-4和IL-13的重要作用是重塑肠上皮,包括杯状细胞和Tuft细胞增生,以及小肠杯状细胞中抵抗素样β(resistin-like beta,Retnlβ)的异位表达【4】。Retnlβ可以直接干扰虫体的生理活动,促进黏液分泌和增强平滑肌收缩性来帮助机体排虫。然而,在2型免疫反应中大量增生的Tuft细胞,其除分泌IL-25以外的生理作用仍是未解之谜。
乙酰胆碱(acetylcholine,ACh)是由胆碱乙酰转移酶(choline acetyltransferase,ChAT)合成的神经递质,能够调节一系列神经和非神经性生理活动【5】。研究表明,神经性ACh可通过基底膜外侧的毒蕈碱样ACh受体(mAChR)调节上皮细胞液体和黏液的释放,而非神经性ACh调节上皮细胞液体分泌的功能也偶有报道。小鼠和人的Tuft细胞中有ChAT蛋白的表达,具有合成和释放ACh的功能。通过这一胆碱能特性,气道中的Tuft细胞可以控制呼吸反射和响应细菌群体感受分子的黏膜纤毛清除;鼻腔中的Tuft细胞可以调节呼吸和刺激物引起的炎症;尿道中的Tuft细胞可以响应外源性苦味化合物将胆碱能信号传导给内脏感觉神经元来控制排尿反射。
通常认为,机体清除肠道寄生的虫体涉及2个关键的步骤。第一步是2型免疫应答的激活引起肠道上皮细胞的重塑,导致黏液和抗菌肽(anti-microbial peptides,AMP)分泌增加以及平滑肌细胞表面AChR表达上调。第二步,上皮细胞通过囊性纤维化跨膜电导调节器(cystic fibrosis transmembrane conductance regulator,CFTR)和钙激活氯离子通道控制氯离子(Cl-)的分泌,进而产生细胞内外的离子浓度差驱使Na+和水分子进入肠腔,与黏液水合后对肠上皮进行“冲洗”,也就是“weep”反应,与此同时AChR接收到ACh的信号传导刺激平滑肌细胞收缩从而进行“sweep”反应,完成排虫作用【6】。有意思的是,常规的抗肠道寄生虫药物(左旋咪唑和吡喃酮)都是胆碱能受体激动剂。它们可以作用于虫体AChR使虫体麻痹来帮助机体排虫,而肠道被激活的胆碱能Tuft细胞,其在肠道排虫作用中所扮演的角色仍是未知的。
近日,Immunity杂志背靠背发表华盛顿医学院Tyler E. Billipp研究团队题为Tuft cell-derived acetylcholine promotes epithelial chloride secretion and intestinal helminth clearance的研究文章和法国蒙彼利埃大学功能基因研究所Marième Ndijm研究团队题为Tuft cell acetylcholine is released into the gut lumen to promote anti-helminth immunity的研究文章。这两项研究揭示肠道Tuft细胞来源的Ach不仅增强肠上皮细胞Cl-和水分子的释放,还能以虫体毒蕈碱受体依赖途径直接抑制寄生虫的繁殖能力,进而促进肠道清除寄生虫,为进一步理解Tuft细胞生理功能提供思路。


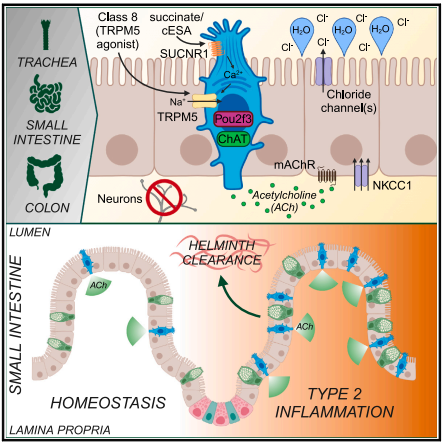
首先,研究人员使用免疫荧光在Chat-GFP(Tg+);Il25RFP/+双报告基因小鼠分析Chat-GFP与Tuft细胞标记物DCLK1的共定位,结果显示近端小肠上皮细胞(proximal small intestine,pSI;小肠最前端5-10 cm)和远端小肠上皮细胞(distal small intestine,dSI;小肠最后端5-10 cm)都有GFP+DCLK1+细胞,且流式细胞术发现99%的GFP+细胞都同时表达Tuft细胞特异性报告基因Il25,但不是所有的Tuft细胞都是GFP阳性的。另外,从pSI到dSI的流式细胞发现GFP+Tuft细胞的占比为40%到80%。研究人员在Chat-Cre;Rosa26-CAG-LSL-tdTomato小鼠中得到了相同的结果。然而这与其他组织中Tuft细胞几乎都表达Chat的结果相悖。因此,研究人员猜想Chat可能标记的是不同转录特征的Tuft细胞亚型。为验证这一猜想,研究人员分别收集了GFP+和GFP-的Tuft细胞行RNA-seq分析。结果发现,GFP-的细胞中Chat的表达是GFP+细胞中的1/3,Sucnr1和Gnat3在GFP+细胞中上调。研究人员还发现不论是肠隐窝还是肠绒毛处都存在着GFP+和GFP-的Tuft细胞,这表明Chat-的细胞也并不是未成熟Tuft细胞,且Chat的表达不依赖于IL-4或IL-13的诱导,因此Chat在Tuft细胞中表达的机制仍有待研究。
随后,研究人员通过尤斯灌流室(Ussing chambers)实时监测SI上皮电生理活动,在这个系统中,带电离子 (如Cl-) 穿过上皮细胞的量与可测量的“短路”电流(short-circuit,Isc)成正比。Na+琥珀酸盐作为小肠Tuft细胞的最佳刺激物能够诱导短暂增加的Isc,作为对照钠离子诱导的反应远小于琥珀酸盐,且具有与ACh模拟物卡巴胆碱(carbachol,CCh)相似的电动力学。在Sucnr1-/-小鼠,琥珀酸盐诱导的反应几乎消失,但由于有钠离子存在仍残留有部分电反应。因此,研究人员使用合成的SUCNR1受体激动剂环氧琥珀酸(cis-epoxysuccinic acid,cESA)来代替琥珀酸盐进行后续的实验,cESA完全依赖于Sucnr1而具有和琥珀酸盐同样的作用。
cESA可以通过SUCNR1诱导肠腔侧的离子流,CCh可以通过mAChR诱导基底侧的离子流。使用阿米洛利封闭Na+通道,并不影响cESA反应,而抑制Cl-通道减少了CCh的反应且几乎检测不到cESA反应。使用Cl-转运蛋白NKCC1抑制剂布美他尼,同样减少了cESA反应。因此,cESA是通过刺激Cl-分泌而短暂增加Isc。随后研究人员利用Tuft细胞特异性 Chat敲除小鼠(Chatfl/fl;Pou2f3Cre-ERT2/+)发现,Tuft来源ACh是cESA反应所必需的,且在Chat缺陷鼠和mAChR抑制剂阿托品处理鼠中,cESA和CCh反应都消失,表明Tuft细胞感受琥珀酸盐/cESA后通过mAChR驱使ACh依赖的Cl-分泌。那么是否还有别的细胞影响Cl-分泌呢?研究人员通过一系列实验发现,琥珀酸盐/cESA诱导Cl-分泌是不需要肠道神经元、巨噬细胞或黏膜下组织参与的。研究人员又通过使用Il25-/-和 Alox5fl/fl;Vil1-Cre1000(Tg+)小鼠、PGD2抑制剂布洛芬、ATP传导蛋白P2RY2抑制剂PPADS和AR-C118925XX及缝隙连接抑制剂甘珀酸排除了其他因素对cESA或CCh诱导Cl-分泌的影响。总之,这些数据表明dSI的Tuft细胞感受肠腔琥珀酸/cESA的刺激向基底侧释放ACh,刺激mAChR依赖的Cl-分泌。该反应是上皮细胞固有的且不需要其他Tuft细胞效应物、肠道神经元或肥大细胞参与。
巴西日圆线虫(Nippostrongylus braziliense,N.braziliense)和多形螺旋线虫(Heligmosomoides polygyrus,H.polygyrus)等寄生虫感染时主要寄生于pSI,进一步研究发现,由于pSI缺乏琥珀酸盐受体(Sucnr1)表达,因此在pSI琥珀酸盐不刺激Cl-分泌,但CCh可以,表明pSI的Tuft细胞在经过某种适当的刺激后,仍然可以诱导液体分泌。随后研究人员发现不管是N.braziliense的虫体蛋白还是其代谢物N-C11-G,亦或是小分子化合物都不能刺激Tuft细胞Cl-分泌。最后,研究人员直接刺激TRPM5,因为迄今为止发现的所有Tuft细胞化学感应途径都集中在TRPM5上。TRPM5激动剂C8能够诱导近端和远端小肠Tuft细胞释放ACh进而导致管腔侧和基底侧Cl-分泌。结肠组织对琥珀酸盐的响应很弱,但对C8有响应且近端结肠强于远端结肠。因此,Tuft细胞控制上皮细胞Cl-分泌是跨屏障组织的共同效应功能。为了测试在体内激活Tuft细胞是否会诱导液体分泌,研究人员用C8或溶剂灌胃小鼠,并在3小时后测量粪便颗粒的湿重,发现C8阻止了粪便湿重的降低,因此,肠道Tuft细胞激活导致ACh依赖的Cl-分泌从而驱动水分子向肠腔流动。
毛滴虫(Tritrichomonas sp.)感染动物模型发现,Chat和Tuft细胞不能影响其定值的位置和数量,提示Tuft细胞来源ACh可能对原虫感染没有作用。为了进一步检测其对清除蠕虫的作用,研究人员测定了野生型和Chat缺陷小鼠在感染N. braziliense 7 d后的肠道虫荷,发现感染第7 d和第9 d Chat缺陷小鼠虫荷都明显多于野生型小鼠,但到了14 d两组之间反而没有差别,表明可能存在其他的免疫反应进行了补偿。因此,与IL-25或LTC4的产生减少类似,Tuft细胞中ACh的合成减少会延缓蠕虫清除,这表明ACh是至少三种协同调节抗蠕虫免疫的Tuft细胞效应分子之一。
为了在体内测试由Tuft细胞产生的ACh是否能激活ILC2s,研究人员使用Chatfl/fl;Pou2f3ERT2-Cre/+小鼠,检测N. braziliense感染后肠固有层和肠系膜淋巴结中ILC2的数量,发现Tuft细胞来源的ACh对蠕虫感染时小肠中ILC2的激活并不重要。同样的模型中发现,与IL-25或LTC4不同的是,ACh似乎不能导致2型炎症反应的发生,且对肠道上皮重塑没有作用。既然ACh不能调节肠道重塑,那么是否有可能通过影响平滑肌收缩性而发挥 “sweep”作用从而排虫呢?
研究人员随后又对Tuft细胞来源ACh是否调节肠道收缩性进行了研究,发现N. braziliense感染后Chat敲除鼠的小肠通过时间没有改变,表明缺乏Tuft来源ACh的肠道排虫时间的延迟,不是由平滑肌功能改变引起。研究人员又进一步发现,在感染7 d后小肠Tuft细胞数量最多时,pSI对琥珀酸盐或cESA的刺激没有反应,而dSI对琥珀酸盐或cESA的刺激增加了约30%。在2型免疫重塑过程中,Tuft细胞数量的增加促进了琥珀酸诱导的离子通量的增加及液体分泌的增多。总之,在小肠发生2型免疫炎症时,增多的Chat+Tuft适度增加了总Cl-的分泌,且Tuft细胞来源的ACh显著升高上皮细胞比例。
在另一篇背靠背文章中,研究人员同样发现Chat基因特异性表达于小鼠小肠上皮Tuft细胞中。后续实验证实肠上皮Tuft细胞来源的Ach直接作用于蠕虫并介导AChR依赖的繁殖力降低。
综上所述,这两项研究均指出肠道Tuft细胞来源的乙酰胆碱在抗蠕虫感染中的重要作用,一方面,乙酰胆碱增强上皮细胞Cl-和液体分泌增强“weep”作用,另一方面降低虫体适应和繁殖能力,为Tuft细胞的生理作用提出新的见解。
模式图(Credit: Immunity)
参考文献
1. Gerbe F., Sidot E., Smyth D.J., Ohmoto M., Matsumoto I., Dardalhon V., Cesses P., Garnier L., Pouzolles M., Brulin B., et al. (2016). Intestinal epithelial tuft cells initiate type 2 mucosal immunity to helminth parasites. Nature 529, 226–230. doi.org/10.1038/nature16527.
2. Howitt M.R., Lavoie S., Michaud M., Blum A.M., Tran S.V., Weinstock J.V., Gallini C.A., Redding K., Margolskee R.F., Osborne L.C., et al. (2016). Tuft cells, taste-chemosensory cells, orchestrate parasite type 2 immunity in the gut. Science 351, 1329–1333. doi.org/10.1126/science.aaf1648.
3. von Moltke J., Ji M., Liang H.-E., and Locksley R.M. (2016). Tuft-cell derived IL-25 regulates an intestinal ILC2–epithelial response circuit. Nature 529, 221–225. doi.org/10.1038/nature16161.
4. Artis D., Wang M.L., Keilbaugh S.A., He W., Brenes M., Swain G.P., Knight P.A., Donaldson D.D., Lazar M.A., Miller H.R.P., et al. (2004). RELMbeta/FIZZ2 is a goblet cell specific immune-effector molecule in the gastrointestinal tract. Proc. Natl. Acad. Sci. USA 101, 13596–13600. doi.org/10.1073/pnas.0404034101.
5. Wessler I., and Kirkpatrick C.J. (2020). Cholinergic signaling controls immune functions and promotes homeostasis. Int. Immunopharmacol. 83, 106345. doi.org/10.1016/j.intimp.2020.106345.
6. Grencis, R.K. (2015). Immunity to helminths: resistance, regulation, and susceptibility to gastrointestinal nematodes. Annu. Rev. Immunol. 33, 201–225. https://doi.org/10.1146/annurev-immunol-032713-120218.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


