JECC: RNAm6A去甲基酶FTO介导的LINC00022表观遗传上调促进食管鳞癌发生
来源:本站原创 2021-09-24 10:16
长非编码RNA(LncRNA)控制细胞增殖,在食管鳞状细胞癌(ESCC)的发生发展中起重要作用。N6-甲基腺苷(M6A)修饰现在被认为是RNA功能的主要驱动力,以维持癌细胞的动态平衡。
长非编码RNA(LncRNA)控制细胞增殖,在食管鳞状细胞癌(ESCC)的发生发展中起重要作用。N6-甲基腺苷(M6A)修饰现在被认为是RNA功能的主要驱动力,以维持癌细胞的动态平衡。然而,m6A如何调控lncRNA功能及其在食管癌发生发展中的作用仍不清楚。
图片链接:https://doi.org/10.1186/s13046-021-02096-1
食管癌(ESCA)是世界上最致命的恶性肿瘤之一,对全球人类健康构成严重挑战。食管鳞癌由两种主要病理亚型组成,即食管鳞状细胞癌(ESCC)和食管腺癌(EAC),这两种病理亚型在地理和流行病学上存在明显差异。东亚的ESCA发病率最高,部分原因是中国的发病率。在所有中国ESCA患者中,ESCC占90%以上。
由于饮食的改善和医学的进步,全球ESCA的发病率从2012年的第7位逐渐下降到2020年的第10位。然而,在过去的十年中,ESCA的全球年死亡率仍然位居癌症死亡的第六位。晚期ESCA患者的5年存活率仍然令人沮丧,原因是肿瘤生长和复发得不到控制,分子机制不明。
在过去的几十年里,人们对ESCC发病的分子机制进行了大量的研究。基因(包括TP53和NFE2L2等抑癌基因的突变)和表观遗传学改变(包括DNA甲基化和非编码RNA)都被发现在食管癌的发生和发展中起着关键作用。多方面的基因表达失衡,如原癌基因扩增、突变、缺失、表观遗传修饰等,可以共同维持食管癌的恶性生物学特性。然而,对食管鳞癌的致癌机制的了解仍不明朗,从而限制了靶向治疗的有效药物开发。
N6-甲基腺苷(M6A)是一种普遍存在的化学修饰,在真核细胞中大量存在,并受一系列特异性甲基转移酶(Writer)、去甲基化酶(ERASER)和阅读器(Reader)的调节。通过调控m6A对mRNA分子的修饰水平,调节失调的m6A调节因子影响mrna的稳定性和翻译效率,以及与肿瘤相关的生物学过程,如细胞增殖和转移。此外,人类肿瘤中m6A调节因子的功能及其介导的RNA m6A修饰水平具有背景依赖性。例如,METTL14的过表达通过介导初级microRNA加工来降低肝癌细胞的转移能力。
在胰腺癌中,上调的METTL14通过增加PERP翻译来刺激肿瘤的生长和转移。这些开创性的研究表明,类似于其他表观遗传修饰,如DNA甲基化和组蛋白乙酰化,m6A提供了一个表观转录层,用于在转录后水平上控制RNA的命运和基因表达。然而,M6A在食管鳞癌中的作用和机制尚不清楚。
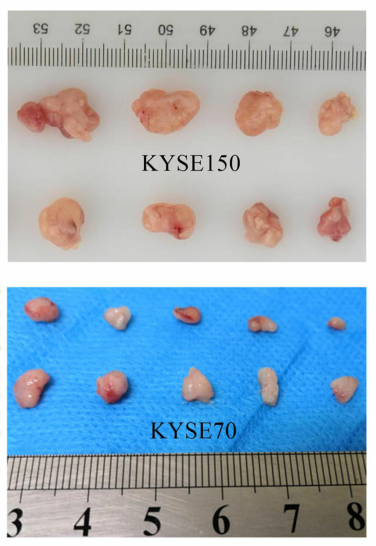
LINC00022促进食管鳞癌体内致瘤作用
图片链接:https://doi.org/10.1186/s13046-021-02096-1
越来越多的证据表明,lncRNAs通过基因表达调控在重塑细胞活性和基因组稳定性方面起着至关重要的作用。进一步的深入研究表明,lncRNA通过与内源性生物分子(如mrna、microrna和蛋白质)直接相互作用来调节肿瘤的发生和肿瘤免疫学。LncRNAs的条件特异性和组织特异性表达模式表明其作为肿瘤的临床靶点和生物标志物具有巨大的潜力。特别是,目前还不清楚m6A是否调节食管癌中的lncRNA,以及m6A/lncRNA的相互作用如何参与食管癌的发生。
在此,作者研究了一种新的lncRNA LINC00022在体外和体内促进食管癌细胞生长的功能。作者发现它通过RNA与蛋白质的直接结合增强了细胞周期蛋白依赖性激酶抑制剂(CDKI)p21的不稳定性。RNAm6A去甲基化酶FTO以YTHDF2依赖的方式表观调控食管癌LINC00022的表达。为此,FTO与LINC00022协同推动食管癌的发生,从而为以FTO/LINC00022轴为靶点作为一种新的治疗策略提供了理论基础。(生物谷
Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



