袁进教授团队建立工程化外泌体可溶性微针角膜炎症干预新策略
来源: 中山眼科中心 2024-09-19 13:06
该研究通过构建aT-Exo,靶向抑制角膜碱烧伤引起的炎症反应,促进角膜的修复和再生,结合构建的PVA-MNs实现外泌体的精确和持续角膜递送。
角膜是维持清晰视觉的前提和基础,化学性外伤、免疫性疾病引起的炎症反应导致伤口愈合延迟,破坏角膜正常结构与功能,严重者如角膜碱性化学伤导致失明,严重威胁患者视力健康。现有的临床治疗方法存在诸多局限性,促使研究者不断探索高效、安全的创新疗法。
近期,中山大学中山眼科中心袁进教授团队,成功构建了具有靶向抗炎作用的工程化外泌体,创新性的与可溶性微针给药体系相结合,显著抑制角膜碱烧伤导致的炎症反应,改善角膜碱烧伤预后。研究成果近日以题为“Engineered Mesenchymal Stromal Cell Exosomes-Loaded Microneedles Improve Corneal Healing after Chemical Injury”发表在国际知名学术期刊ACS Nano。
研究团队通过基质金属蛋白酶(MMPs)可切割肽链将抗TNF-α抗体(aT)连接于脂肪间充质干细胞外泌体(ADSC-Exo)表面构建工程化外泌体(aT-Exo),通过电镜、免疫荧光共定位、纳米流式及Zeta电位检测等方法检测aT-Exo的特征(图1)。

图1. aT-Exo的构建、形貌及性能表征
构建小鼠角膜碱烧伤模型,结膜下注射aT-Exo,动态分析证实抗TNF-α抗体修饰的工程化外泌体制备技术,提高aT利用率同时,增强外泌体抗炎特异性,显著下调碱烧伤角膜炎症损害并促进角膜损伤修复(图2)。
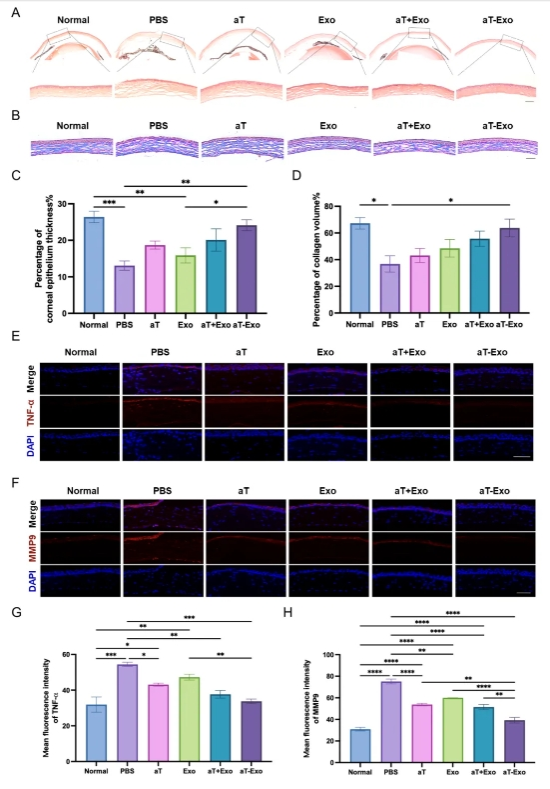
图2. aT-Exo通过抑制炎症减轻角膜化学损伤
在角膜上皮细胞与M1型巨噬细胞共培养体系中,aT-Exo可以通过促进巨噬细胞M2型极化,显著降低共培养体系中的TNF-α、MMP9、IL-6和IL-1β表达(图3)。

图3. aT-Exo通过抑制炎症因子的释放保护角膜上皮细胞
为了克服传统眼局部给药,组织穿透性和生物利用度低的局限性,研究团队采用聚乙烯醇(PVA)构建微针(MNs)阵列,实现工程化外泌体跨角膜上皮递送。显示载外泌体微针具有足够的强度有效穿进角膜基质层,相比于传统给药方式,MNs具有更高的角膜药物利用率和更长的药物释放时间,实现外泌体的靶向递送(图4)。
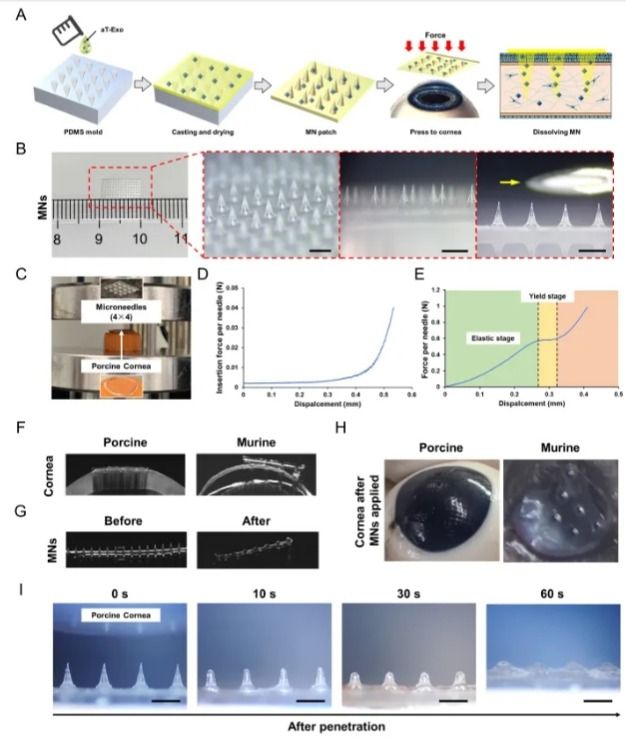
图4.MNs的构建和跨角膜上皮药物递送评价
小鼠角膜碱烧伤动物模型中,aT-Exo分别通过滴眼液(E-Drop)、结膜下注射(E-Conj)和微针(E-MN)形式进行给药,结果显示MNs递送系统能够有效提高外泌体的生物利用度,增强角膜炎症控制效果(图5)。
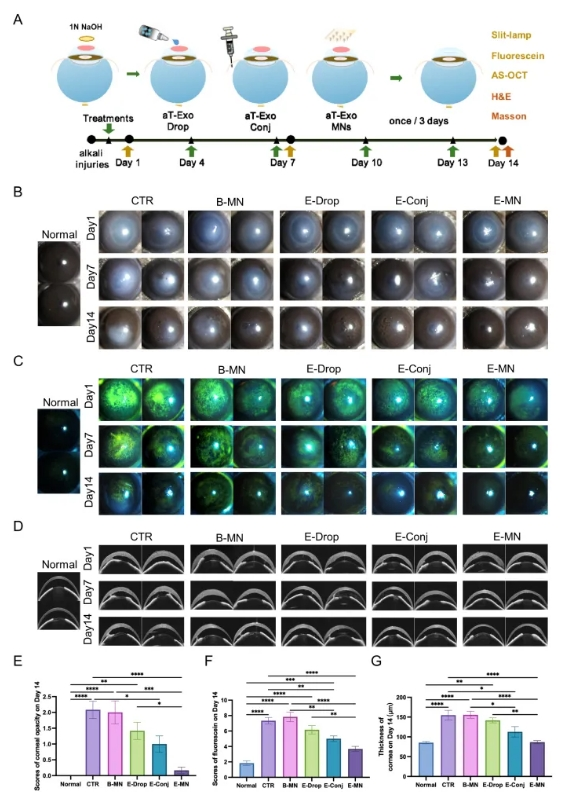
图5. MNs递送aT-Exo干预小鼠角膜碱烧伤
该研究通过构建aT-Exo,靶向抑制角膜碱烧伤引起的炎症反应,促进角膜的修复和再生,结合构建的PVA-MNs实现外泌体的精确和持续角膜递送,展示了工程化外泌体干预角膜炎症相关疾病的临床应用前景,同时证实微针技术在眼部生物活性纳米药物递送中的潜力 (图6) 。
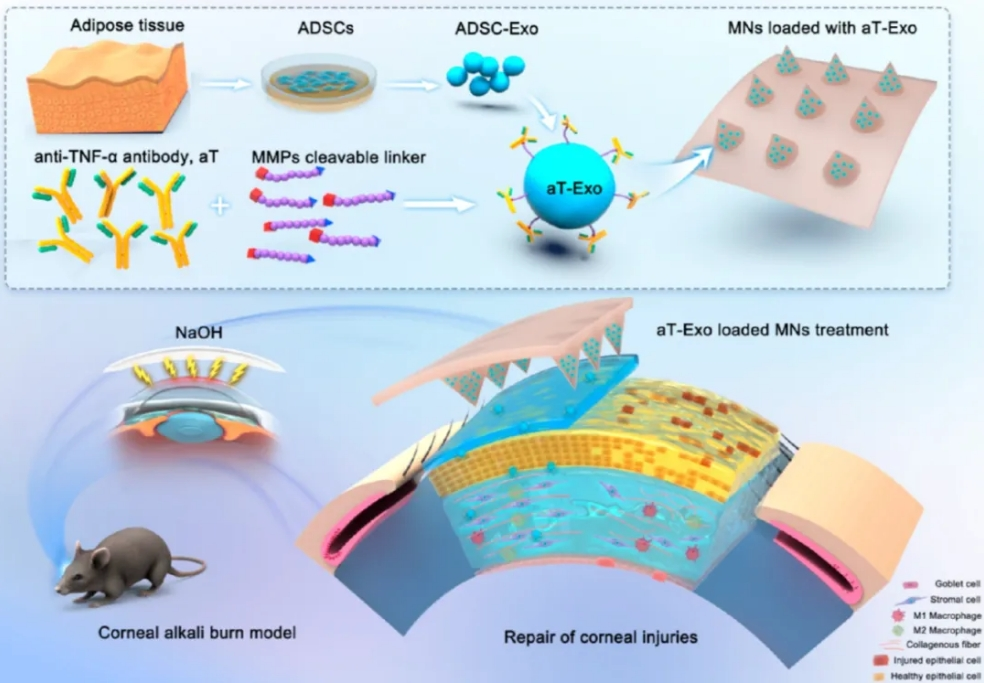
图6. 装载工程化外泌体(aT-Exo)的微针体系效果机制模式图
中山大学中山眼科中心、眼病防治全国重点实验室为第一单位,中山眼科中心袁进教授、李赛群副主任医师和香港大学刘璐教授为共同通讯作者,中山眼科中心余菲博士后、赵轩副研究员和汪倩博士后为共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


