研究实现可调结构的蛋白质晶体的非共价自组装
来源:苏州纳米所 2021-03-16 08:51
操控纳米级构筑基元组装成高度有序的晶体结构已引起科研人员的研究兴趣。通过优化无机纳米颗粒的类型、尺寸、晶格参数和晶体对称性,可在热力学或动力学上调控其自组装过程,进而获得一元、二元和三元的晶体结构。源于高度有序排列所产生的新兴特性和多样的化学功能,这些自组装结构在催化、磁学、光学和功能生物材料等领域具有广泛的应用前景。以功能蛋白为基元结构精确构建结构可调的周
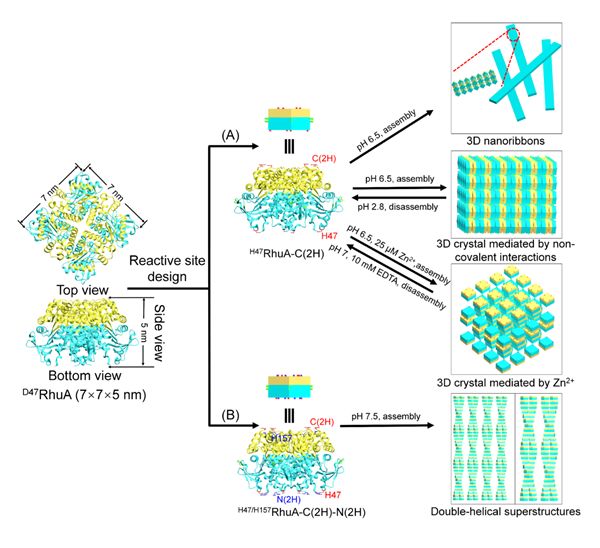
操控纳米级构筑基元组装成高度有序的晶体结构已引起科研人员的研究兴趣。通过优化无机纳米颗粒的类型、尺寸、晶格参数和晶体对称性,可在热力学或动力学上调控其自组装过程,进而获得一元、二元和三元的晶体结构。源于高度有序排列所产生的新兴特性和多样的化学功能,这些自组装结构在催化、磁学、光学和功能生物材料等领域具有广泛的应用前景。以功能蛋白为基元结构精确构建结构可调的周期阵列是有趣的研究方向,然而,蛋白质表面的化学和结构复杂性,特别是对于非球形蛋白质模块而言,如何将各向异性的蛋白质基元可控组装成具有可调结构特性的蛋白质晶体仍是主要挑战。
近日,中国科学院苏州纳米技术与纳米仿生研究所研究员强斌团队利用一种各向异性的L-鼠李树胶糖-1-磷酸醛缩酶(RhuA)作为构筑基元,通过在蛋白质三维(3D)空间位点引入组氨酸残基并精确调控其相互作用,实现了将各向异性的非球形RhuA蛋白质自组装成高度有序的、具有不同形态和结构的蛋白质晶体。基于组氨酸的π -π作用,通过热力学调控RhuA的自组装过程,获得了3D纳米带和3D四方相晶体结构;通过引入强的金属离子-组氨酸螯合作用,从动力学上调控了RhuA自组装成3D四方相晶体结构。此外,通过在RhuA模块表面上设计另一种组氨酸的排布,进一步构建出RhuA蛋白质双螺旋3D超结构。利用荧光显微镜、透射电子显微镜(TEM)、原子力显微镜(AFM)和小角度X射线散射(SAXS)测定了它们的结构性质和动态组装性质。该研究旨在拓展可调控、高度有序的蛋白质超结构可编程的工具盒,有助于理解蛋白质界面相互作用机制。
相关研究成果以Noncovalent Self-Assembly of Protein Crystals with Tunable Structures为题,发表在Nano Letters上(DOI: 10.1021/acs.nanolett.0c04587)。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


