寻找蓝海里的“珍珠”:云顶新耀多款创新产品即将商业化
来源:网络 2023-08-08 12:48
2023年7月27日,云顶新耀宣布创新型强效抗菌药物依拉环素(商品名:依嘉®)成功在中国商业化上市。依拉环素的成功上市,标志着云顶新耀正走向集研发、临床、生产、商业于一体的全产业链布局。
2023年7月27日,云顶新耀宣布创新型强效抗菌药物依拉环素(商品名:依嘉®)成功在中国商业化上市。依拉环素的成功上市,标志着云顶新耀正走向集研发、临床、生产、商业于一体的全产业链布局。
云顶新耀首席执行官罗永庆表示:“依拉环素在中国成功商业化上市是一个十分重要的里程碑,这样就意味着云顶新耀从临床阶段进入到商业化阶段。未来,我们还将继续推进耐赋康等其他疾病首创或同类最佳候选药物的上市批准和商业化,以进一步满足中国和其他亚洲地区尚未满足的医疗需求。”
广谱抗感染“新三剑客”:依拉环素、头孢吡肟/他尼硼巴坦、EVER206
细菌耐药性已成为全球主要公共卫生威胁之一。2022年,Lancet杂志发表了一篇细菌耐药性全球负担综述显示,2019年全球估计有4.95亿死亡病例与细菌耐药性有关,1.27亿死亡病例归因于细菌耐药性,而多重耐药革兰阴性感染治疗已成为核心难题。
多重耐药性的问题在ICU中最为明显。EPIC III在15165名人群调查结果显示,ICU内感染死亡率为30.3%。在疑似或确诊感染的患者中,65%患者至少有1次微生物培养阳性,其中,67%患者检出革兰阴性菌,37%检出革兰阳性菌。同时,近十年来,我国碳青霉烯耐药菌检出率增高,导致抗菌治疗选择有限且死亡率高,药物治疗十分有限,临床亟需新型强效抗菌药物解决“无药可用”的耐药感染困境。
今年3月,由云顶新耀引进的依拉环素获得中国国家药品监督管理局(NMPA)的批准,用于治疗成人复杂性腹腔内感染(cIAI),该药是全球首个氟环素类抗菌药物,具有全新的化学结构,抗菌谱广,抗菌活性更强,组织浓度更高,且安全性更好。而依拉环素在中国的获批上市,将成为中国临床耐药菌感染经验性治疗不可或缺的选择。
图:依拉环素分子式
据罗永庆介绍,依拉环素是云顶新耀从Tetraphase制药公司授权引进的全球首个氟环素类抗菌药物,对临床常见和重要的多重耐药菌如产ESBLs菌、CRE、CRAB、MRSA和VRE等具有强大的抗菌活性,组织浓度高且协同无拮抗。
依拉环素的我国获批上市是基于IGNITE 1/4试验以及国内桥接试验的积极结果,结果显示,依拉环素治疗复杂腹腔内感染(cIAI)的疗效不劣于碳青霉烯类药物,而且腹泻等胃肠道反应的发生率更低。在真实世界研究中,依拉环素的疗效和安全性再次得到印证,而且拓展了抗感染治疗的应用场景,包括肺炎、骨关节和皮肤软组织感染、糖尿病足、脓胸、血流感染、导管相关感染等。
在丰富的循证医学证据基础上,依拉环素已被国内外多部权威指南或专家共识所推荐。依拉环素已被美国传染病学会(IDSA)和欧洲临床微生物学和传染病学会(ESCMID)发布的多个全球治疗指南推荐为包括碳青霉烯类耐药在内的多重耐药性革兰阴性菌感染的治疗方案。同时,该药也被纳入由中华医学会外科学分会、中国研究型医院学会感染性疾病循证与转化专业委员会和中华外科杂志编辑部联合发布的《外科常见腹腔感染多学科诊治专家共识》。2023年2月被《碳青霉烯耐药革兰阴性菌诊治和防控指南》纳入并推荐。
当然,云顶新耀的在抗感染领域的野心绝不止于此。罗永庆表示,“在广谱抗感染领域,除了依拉环素,我们还布局了头孢吡肟/他尼硼巴坦 (Taniborbactam)、EVER206 (SPR206)。其中,头孢吡肟/他尼硼巴坦已完成全球和中国的三期临床试验且获得了积极的数据,预计将于今年年底在中国提交用于治疗复杂性尿路感染的新药上市申请,EVER206则已完成全球和中国的一期临床试验。“依拉环素、头孢吡肟/他尼硼巴坦、EVER206将组成’新三剑客’,更好地满足临床需求。
从肾内到自免疫,下一个“王牌”产品即将获批
随着依拉环素的上市,2023年成为云顶新耀转型升级、价值增长的关键之年。另一颗蓝海中的珍珠——肾病,也是云顶新耀重点关注的领域之一。云顶新耀内科领域首席医学官朱正缨表示,“中国是世界上原发性肾小球疾病发病率最高的国家,而IgA肾病是中国最常见的原发性肾小球疾病。我国约有500万IgA肾病患者,预估每年有10万新诊断的IgA肾病患者,约50%的患者在10-20年内可能进展为终末期肾病。
“目前,国内针对IgA肾病的治疗并未有特异性的治疗手段,主要还是以RAS抑制剂的支持性治疗和全身免疫抑制剂为主,约80%的IgA肾病患者确诊年龄在15~44岁之间,对接受创新疗法的意愿强烈。”朱正缨强调。
耐赋康(Nefecon)是全球首个针对IgA肾病的靶向治疗药物,专为IgA肾病患者研制。Nefecon是一款口服靶向布地奈德迟释胶囊,靶向作用于回肠末端的黏膜B细胞(包括派尔集合淋巴结),从而减少诱发IgA肾病的半乳糖缺陷的IgA1抗体(Gd-IgA1)产生,进而干预发病机制上游阶段,达到治疗IgA肾病的作用。
目前,Nefecon 3期临床研究数据已公布,显著降低蛋白尿和血尿,延缓50%肾功能下降。具体而言,在肾功能方面,24个月时,Nefecon治疗组eGFR自基线下降幅度为6.11ml/min/1.73m2,而安慰剂组西江12.00ml/min/1.73m2,提示9个月的Nefecon治疗在随访2年时可显著延缓肾功能衰退达50%。同时,Nefecon持续降低蛋白尿,最大降幅达51.3%,即使在停药后15个月仍能观察到持久效果。经过9个月的Nefecon治疗,在随访15个月期间,与安慰剂相比,Nefecon组患者伴有镜下血尿的风险减少60%。
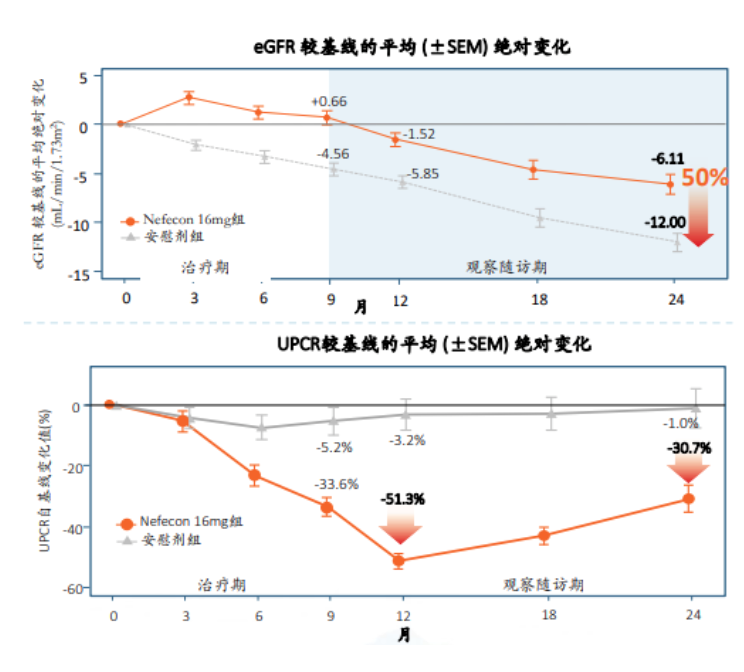
图:Nefecon3期临床研究数据结果
据了解,2019年6月,云顶新耀与Calliditas公司签订独家授权许可协议,获得Nefecon在大中华地区和新加坡的开发和商业化权利。该协议于 2022 年 3 月扩展,将韩国纳入云顶新耀的授权许可范围。2022年11月,国家药监局受理了云顶新耀就耐赋康的新药上市申请,并已纳入突破性治疗品种且授予优先审评资格,预计将于今年下半年获批。同时,在今年,云顶新耀还会继续递交耐赋康在中国香港、中国台湾地区以及韩国的上市申请。
值得一提的是,云顶新耀也正在开发其他具有前景的针对肾小球疾病的治疗药物管线。以EVER001为例,EVER001是新一代共价可逆的布鲁顿酪氨酸激酶(BTK)抑制剂,正在开发用于治疗肾小球疾病,已于去年9月获批开展Ib期临床试验。同时,口服小分子选择性鞘氨醇-1-磷酸(S1P)受体调节剂ETRASIMOD(伊曲莫德)正在被云顶新耀所开发,有潜力成为溃疡性结肠炎等自身免疫疾病的同类领先治疗方案。
“在过去,云顶新耀取得了令人瞩目的成绩,如今我们从成功的授权引进模式逐步发展到兼具强大的自主研发和业务拓展能力的双轮驱动模式,这种战略模式让我们实现’以最快的速度、最高效的投入、惠及最多患者’的目标。”最后,罗永庆说道。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


