阿尔茨海默病新药Donanemab的诞生之路:穿越“死亡谷”,闯过“拷问局”
来源:医药魔方 2024-07-13 09:32
自2001年至今,历经23年的坎坷,礼来终于在Aβ赛道交出了一份满意的答卷。阿尔茨海默病这个新药研发“死亡谷”也在研究人员们前赴后继的尝试中逐渐出现了生机。
历经多年坎坷之后,新一代抗Aβ抗体Donanemab终于在近日拿到了FDA的通行证。阿尔茨海默病(AD)领域的新药研发工作向来不易,成千上万的分子折戟于此,时至今日也仅3款靶向药物获批上市。正因如此,阿尔茨海默病也被制药界公认为新药研发的“死亡谷”。当Donanemab获批的消息传来,既是整个制药行业的一次狂欢,也是阿尔茨海默病患者渴求多年的一场甘霖。
从发现到获批,Donanemab的成药之旅可谓是“过五关斩六将”,单是FDA审批这一关便走了三遭,争议不断的Aβ学说更是一度让Donanemab遭受诸多质疑。十多年来,Donanemab究竟是如何一步一步走向成功的?相信今天的文章能够给大家一个答案。
故事的开头:近百年奠基,“Aβ假说”问世
在日常生活的某个瞬间,我们也许会发现身边的长辈竟然像年幼的孩童一样玩闹,或者是无法辨认出眼前朝夕相处的亲人——这是阿尔茨海默病最为明显的病症,也是令患者自身及其亲人备受痛苦的症状。
其实,这种疾病在一百多年前便已被发现[1]。1906年11月3日,德国精神科医生Alois Alzheimer在一年一度的德国西南部精神病学年会上报告了一位女性——Auguste Deter的病例。这位患者在5年前出现了奇怪的症状——记忆力衰退、多疑、错觉频生、精神错乱。由于无法接受有效的治疗,Auguste Deter在日复一日的精神折磨中生活了5年便离开了人世。

Alois Alzheimer(左)和Auguste Deter(右)
在Auguste Deter去世后,Alois Alzheimer对其大脑进行了分析,他发现该患者脑组织中存在大量老年斑(plaques)和神经纤维缠结(tangles)——这便是这份报告最核心的内容,也是后续大量阿尔茨海默病疗法的开发基点。
1910年,这种由Alois Alzheimer最先发现的疾病被正式命名为阿尔茨海默病(Alzheimer Disease)并被写入《精神病学》著作。至此,阿尔茨海默病开始进入众多科学家的视野。
一晃半个世纪过去,神经病理学家Robert Davis Terry发现淀粉样蛋白纤维——即Aβ(amyloid β-protein,于1984年得名[2])是老年斑的主要组成成分[3]。1990年代初,在神经病学专家John Hardy连续发表两篇关于Aβ蛋白的研究性文章后,“Aβ假说”开始风靡科学界,那就是Aβ蛋白形成并积聚导致斑块形成,引发神经纤维缠结,最终导致阿尔茨海默病。

Robert Davis Terry(左)和John Hardy(右)
尽管并非所有人都认同“Aβ假说”,但其盛行确实为靶向Aβ疗法的开发提供了大量理论基础。已上市的3款抗Aβ单抗——阿杜卡尼单抗(Aducanumab)、仑卡奈单抗(Lecanemab)和Donanemab皆是基于该假说开发而来。
故事的中间:强渡新药研发“死亡谷”
一组数据可以说明阿尔茨海默病领域新药开发之艰难。1998-2021年间,198款用于治疗和预防阿尔茨海默病的在研药物开发失败,其中近八成药物在早中期即止步[4],最终只有4款药物获批上市,研发成功率整体上仅为2%。
阿尔茨海默新药开发难度之高一度劝退诸多制药巨头,如罗氏、辉瑞、默沙东,但并没有阻挡住礼来的首席科学官(CSO)Ronald DeMattos。
在Ronald DeMattos看来,临床中确诊的阿尔茨海默病患者大脑中已然形成了淀粉样蛋白斑块,因而开发能够与这些淀粉样蛋白斑块结合从而将其清除的抗体是解决问题的关键。
从“Aβ假说”来看,淀粉样蛋白斑块的积聚需要经过淀粉样前体蛋白(APP)水解→淀粉样蛋白单体(monomers)生成→淀粉样蛋白低聚物(oligomers)形成→淀粉样蛋白沉积(deposits)形成斑块三个过程。从淀粉样蛋白已产生过程出发设计药物符合Ronald DeMattos的开发策略。
因而,礼来首先在2001年开发了靶向结合淀粉样蛋白单体的Solanezumab(苏兰珠单抗)[5]。刚开始,Solanezumab的开发非常顺利,I期研究和II期研究均很快成功完成。但Solanezumab进入III期后开始屡尝败绩,即使入组人群一再调整也于事无补——Solanezumab对轻中度阿尔茨海默病患者(EXPEDITION-1)、轻度阿尔兹海默病患者(EXPEDITION-3)和临床前阿尔茨海默病患者(A4)均无效。但这样一番完整的探索为礼来积累了对阿尔茨海默病更多的认知,Solanezumab也算“死而无憾”。
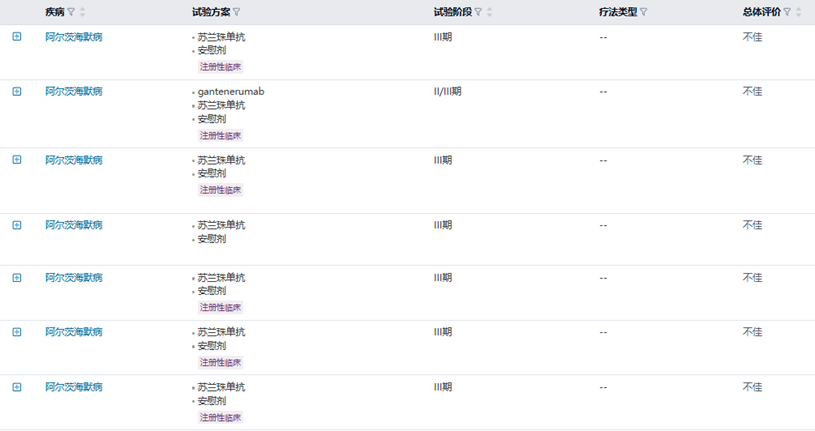
在推进Solanezumab临床开发的同时,Ronald DeMattos已考虑了靶向淀粉样蛋白单体存在的缺陷——血液中和大脑中均存在淀粉样蛋白单体,候选抗Aβ抗体可能在进入大脑前便已被大量消耗,从而使疗效大打折扣。
为了解决这个问题,Ronald DeMattos对大脑中的淀粉样斑块进行了细致研究。他发现,脑部淀粉样斑块存在一个特殊的环状结构——N3pG,即Aβ肽(1-42)N末端的两个氨基酸被切割后剩余的Aβ肽(3-42)N末端会形成吡咯环(焦谷氨酸)[6]。
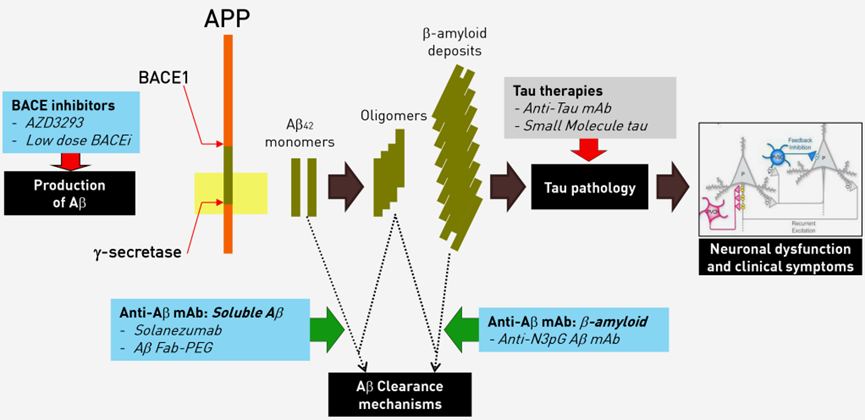
靶向淀粉样斑块的形成过程的药物开发策略
2012年,Ronald DeMattos与Jirong Lu和Ying Tang等人基于此发现开发了特异性靶向Aβ蛋白亚型N3pG的新一代抗Aβ单抗Donanemab[7],这也得益于礼来八年前收购Applied Molecular Evolution时获得的微调抗体技术平台。第二年,礼来迅速将其推进至临床开发阶段,针对伴有轻度认知障碍或轻中度痴呆的阿尔茨海默病患者开展了I期研究[8]。
Donanemab的开局并不算顺利。最初,研究人员发现Donanemab的半衰期(约10天)比预期(约24天)短,并且大约90%的患者在治疗第3个月时产生了抗药性抗体[9]——这意味着Donanemab在进入大脑前即被大量清除。这样的结果让Ronald DeMattos团队再次陷入了被Aβ深坑支配的恐惧。
就在这时,礼来在2010年收购Avid Radiopharmaceuticals而获得的Aβ显像剂Florbetapir F-18派上了用场。在此之前,研究人员只能通过解剖来确认阿尔茨海默病患者大脑中是否存在淀粉样斑块。但Florbetapir F-18可以让显像方式更为便捷,它就像一个追踪器,通过荧光显色让淀粉样蛋白“无处可藏”。
应用Florbetapir F-18重新评估后,Ronald DeMattos团队发现Donanemab(10mg/kg)可将患者的脑淀粉样蛋白水平降低40%-50%!至此,Ronald DeMattos团队总算是松了一口气,在后续的临床研究中也就可以轻装上阵了。
故事的高潮:闯过FDA重重考验,拿到通行证
在II期TRAILBLAZER-ALZ研究取得积极结果后,礼来于2021年10月向FDA递交了Donanemab的加速批准申请,但该申请在2023年1月被FDA回绝。FDA十分谨慎,希望看看注册性III期研究(TRAILBLAZER-ALZ 2)的数据再做决定。
这项III期研究有一个特别之处——额外检测了入组患者的tau蛋白水平。tau蛋白沉积与淀粉样蛋白沉积同为阿尔茨海默病患者的标志性特征,只不过前者在患者大脑中出现的时间一般晚于后者。通过淀粉样蛋白水平和tau蛋白水平的双重限制,可以把关入组患者的质量。
2023年5月,这项研究顺利达到主要终点。数据显示,Donanemab可将中等tau蛋白水平患者的iADRS(评估患者的认知能力和生活自理能力)评分下降速度减缓35%(P<0.0001),并可将其疾病进展至下一阶段的风险降低39%(P<0.001)。若将高tau蛋白水平的患者合并分析,Donanemab依然保持了一致的效果。值得一提的是,当患者达到预定的淀粉样斑块清除标准时,可以停止用药。这一点从前并未有相关药物可以实现。
拿到数据的一个月后,礼来再次向FDA递交了Donanemab用于治疗早期症状性阿尔茨海默病的上市申请,而FDA也承诺将在今年Q1做出审批决定。
不过,FDA还是审慎地延迟了Donanemab的审批进度。今年3月初,FDA决定召开咨询委员会会议讨论Donanemab的两个关键问题(有效性和获益),因此将审批时间推迟至Q2。
上个月月初,礼来方准备充足地参加了此次会议,并在最终投票中获得了11:0的压倒性胜利!一个月后,Donanemab顺利获FDA批准上市。礼来终于彻底地冲破了围绕其多年的Aβ研发迷雾了。
总结
自2001年至今,历经23年的坎坷,礼来终于在Aβ赛道交出了一份满意的答卷。阿尔茨海默病这个新药研发“死亡谷”也在研究人员们前赴后继的尝试中逐渐出现了生机。寻找突破很难,但若成功便甘之如饴。不过,攻克阿尔茨海默病的征途还远未达到终点。目前的抗Aβ抗体只是可以延缓疾病进展,且获益人群还不够大。未来,我们依然需要在更早的阶段让患者摆脱疾病困扰。Donanemab的上市只是第一步,绝不是最后一步,相信这也是礼来心中所想。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


