非脱氨酶依赖的嘧啶碱基编辑器TBE获得进展
来源:网络 2024-08-20 10:24
研究论文报道了一种名为TBE(Thymine base editor)的不依赖脱氨酶的DNA碱基编辑工具。与现存的其他胸腺嘧啶编辑工具相比,TBE表现出更高的编辑效率、更小的细胞毒性和更低的脱靶现象
DNA碱基编辑工具的进步为疾病治疗带来了巨大的希望,可修复由单核苷酸多态性(SNPs)【1】引起的单基因遗传疾病。目前,胞嘧啶碱基编辑器和腺嘌呤碱基编辑器主要依靠脱氨酶将胞嘧啶(C)或腺嘌呤(A)转化为尿嘧啶(U)或肌苷(I),脱氨后的U和I会分别被识别为胸腺嘧啶(T)和鸟嘌呤(G),从而促进C-to-T和A-to-G碱基变化【2-4】。在此基础上,进一步引入DNA糖基化酶切割中间产物U或I,产生无尿嘧啶/无嘧啶位点(AP位点),可以实现碱基的颠换,包括C-to-G转换的CGBE【5、6】和A-to-T/C转换的AYBE【7、8】。但以上碱基编辑工具均依赖脱氨酶,限制了它们编辑T和G的能力,并且由于脱氨酶的过表达会引起一定的脱靶效应。
2024年7月30日,北京大学魏文胜课题组在Nature Communications杂志在线发表题为 “Programmable DNA pyrimidine base editing via engineered uracil-DNA glycosylase”的研究论文,报道了一种名为TBE(Thymine base editor)的不依赖脱氨酶的DNA碱基编辑工具。与现存的其他胸腺嘧啶编辑工具相比,TBE表现出更高的编辑效率、更小的细胞毒性和更低的脱靶现象。
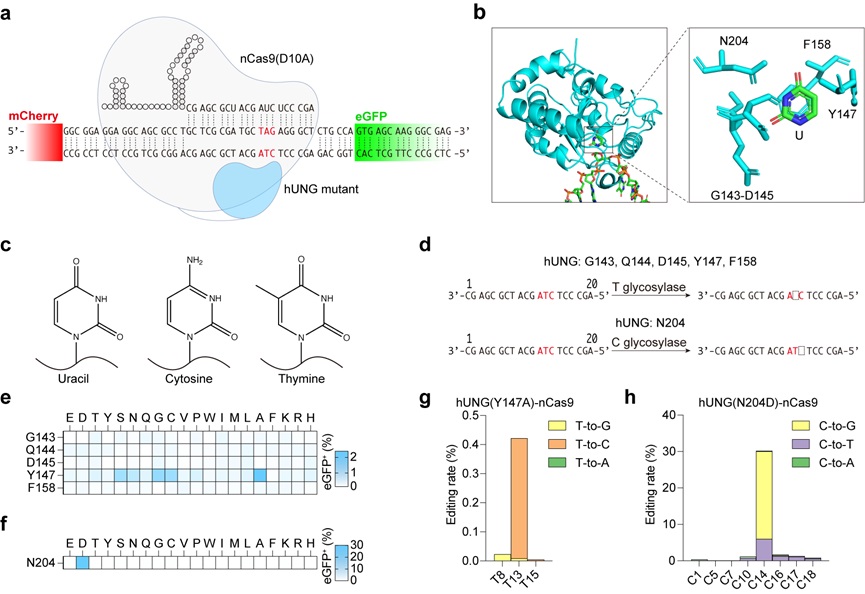
图1: 不依赖于脱氨酶的碱基编辑器
研究人员关注到人源化尿嘧啶DNA-糖基化酶(hUNG)的两个突变体可以在体外实现对胞嘧啶和胸腺嘧啶的直接切割【10】。因此,通过将hUNG突变体与Cas9蛋白结合,sgRNA靶向编辑位点可以在体内实现对DNA序列中的C和T的直接编辑(图1),其中在报告系统上编辑C的效率可达到30%,与现存的CGBE编辑效率类似,但针对T的hUNG突变体编辑效率较低。
为了进一步提高胸腺嘧啶的编辑效率,研究人员通过对UNG结构理性设计、同源蛋白检索、定向进化筛选的策略找到了来自耐辐射奇球菌(Deinococcus radiodurans)的尿嘧啶DNA-糖基化酶(DrUNG)突变体可以在多个人类基因组位点上实现高效的胸腺嘧啶编辑(图2),编辑结果显示平均T-to-C, T-to-G及T-to-A的比例为52%,30%和18%。通过优化连接氨基酸、引入具有合成倾向性的DNA聚合酶,还可以进一步提高编辑效率与编辑纯度。全面评估显示,TBE在基因组或转录组水平上都不会导致严重的脱靶编辑,这表明其具有高度的编辑特异性。

图2: TBEs在人类基因组多个内源位点实现高效的编辑
近期,多个团队也报道了基于人源化糖基化酶的胸腺嘧啶碱基编辑器【11-12】。通过比较32个内源位点编辑结果,研究人员发现与基于人源的胸腺嘧啶碱基编辑器相比,TBE展现出更高的编辑效率。此外,细胞毒性实验也表明TBE具有更小的细胞毒性。
最后,通过将DrUNG突变体的mRNA与nickase SpCas9融合蛋白和sgRNA共转染到原代成纤维细胞中的α-L-艾杜糖醛酸酶缺陷细胞中,可以观察到该酶活性的恢复,证明了TBEs在相关疾病治疗方面的潜在应用前景。
北京大学/昌平实验室魏文胜课题组博士后伊宗裔、博士后张小雪、博士研究生魏晓旭、本科生李佳怡(2024级研究生新生)为论文的共同第一作者。本研究获得了国家自然科学基金,昌平实验室,北大-清华生命科学中心及中国博士后科学基金资助。
【1】 Porto, E.M., Komor, A.C., Slaymaker, I.M. & Yeo, G.W. Base editing: advances and therapeutic opportunities. Nat Rev Drug Discov 19, 839—859 (2020).
【2】 Anzalone, A.V., Koblan, L.W. & Liu, D.R. Genome editing with CRISPR-Cas nucleases, base editors, transposases and prime editors. Nat Biotechnol 38, 824—844 (2020).
【3】 Gaudelli, N.M. et al. Programmable base editing of A*T to G*C in genomic DNA without DNA cleavage. Nature 551, 464—471 (2017).
【4】 Komor, A.C., Kim, Y.B., Packer, M.S., Zuris, J.A. & Liu, D.R. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature 533, 420—424 (2016).
【5】 Zhao, D. et al. Glycosylase base editors enable C-to-A and C-to-G base changes. Nat Biotechnol 39, 35—40 (2021).
【6】 Kurt, I.C. et al. CRISPR C-to-G base editors for inducing targeted DNA transversions in human cells. Nat Biotechnol 39, 41—46 (2021).
【7】 Tong, H. et al. Programmable A-to-Y base editing by fusing an adenine base editor with an N-methylpurine DNA glycosylase. Nat Biotechnol 41, 1080—1084 (2023).
【8】 Chen, L. et al. Adenine transversion editors enable precise, efficient A*T-to-C*G base editing in mammalian cells and embryos. Nat Biotechnol (2023).
【9】 Tong, H. et al. Programmable deaminase-free base editors for G-to-Y conversion by engineered glycosylase. Natl Sci Rev 10, nwad143 (2023).
【10】 Parikh, S.S., Mol, C.D., Slupphaug, G., Bharati, S., Krokan, H.E. & Tainer, J.A. Base excision repair initiation revealed by crystal structures and binding kinetics of human uracil-DNA glycosylase with DNA. EMBO J 17, 5214-5226 (1998).
【11】 Ye, L. et al. Glycosylase-based base editors for efficient T-to-G and C-to-G editing in mammalian cells. Nat Biotechnol (2024).
【12】 He, Y. et al. Protein language models-assisted optimization of a uracil-N-glycosylase variant enables programmable T-to-G and T-to-C base editing. Mol Cell (2024).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


