三篇Cell:科学家揭示免疫疗法协同作用促进黑色素瘤患者机体中T细胞反应背后的分子机制
来源:生物谷原创 2024-08-17 13:01
这三篇研究报告提供了LAG3和PD1如何单独发挥功能以及联合作用背后的分子机制,并强调了利用其进一步进行临床研发的新机会。
近日,发表在国际杂志Cell上的研究报告中,来自匹兹堡大学等机构的科学家们通过研究揭示了靶向作用免疫检查点PD1和LAG3的免疫疗法如何共同发挥作用来激活宿主机体的免疫反应,相关研究结果揭示了为何靶向作用两种检查点的组合性疗法相比仅作用PD1的单一疗法能改善黑色素瘤患者的治疗结局。
利用来自人类临床试验和动物模型的数据,研究人员调查了肿瘤杀伤性CD8+ T细胞的反应,在与癌症的长期斗争中,免疫检查点能在T细胞表面积累,其就好像制动器一样能抑制T细胞的活性并驱动其发生耗竭,能帮助释放这些制动器并抵御T细胞耗竭的免疫检查点抑制剂彻底改变了人类癌症的治疗,但因为很多患者没有产生反应,因此研究人员还需要进行更多的研究来理解如何将这些药物结合起来来改善其效用。
研究者Dario A. A. Vignali博士表示,这些研究首次深入研究了免疫系统对阻断PD1和LAG3的反应,我们发现,靶向作用PD1与PD1和LAG3或许能以惊人的不同方式来调节CD8+ T细胞的功能,理解这些机制与我们如何考虑联合治疗并优化药物的最佳配对有关。早在2022年,靶向作用LAG3的药物relatlimab获得FDA批准,与靶向作用PD-1的纳武单抗(nivolumab)结合使用来治疗转移性黑色素瘤患者,相比单独使用纳武单抗而言,这种组合性疗法能显著改善患者的治疗结果,然而其增强宿主机体抗肿瘤免疫力背后的分子机制,研究人员并不清楚,而最新研究或许就有助于填补这一研究空白。
在第一项研究中,研究者Vignali等人进行了一项临床试验来调查接受relatlimab、纳武单抗或两种药物的黑色素瘤患者机体的免疫反应。通过分析其血液和肿瘤样本,研究人员发现,相比只接受一种药物治疗的患者而言,接受这两种药物的患者机体中CD8+ T细胞的反应会增强,这与改善其机体癌症杀伤效能直接相关,尽管细胞保留了耗竭的特征。
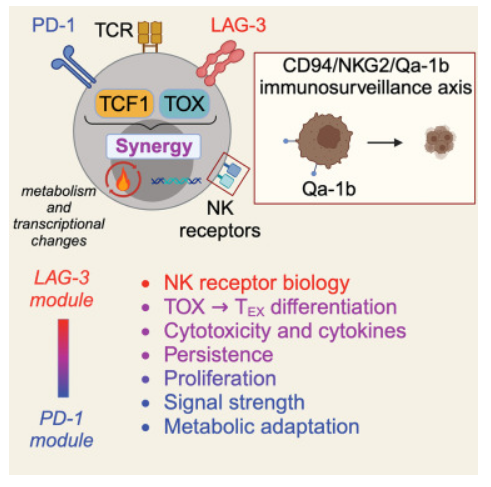
科学家揭示免疫疗法协同作用促进黑色素瘤患者机体中T细胞反应背后的分子机制
图片来源:Cell (2024). DOI:10.1016/j.cell.2024.07.018
研究人员非常惊讶地发现,同时阻断PD1和LAG3所产生的变化要比单独阻断PD1或LAG3所产生的效果要大得多,研究结果表明,这些免疫检查点能抑制CD8+ T细胞功能的不同方面,从而就使其能以一种意想不到的方式来进行协同作用。据研究者介绍,分析患者机体样本的关键之处在于relatlimab药物并不是惰性的,而这项研究的独特之处在于,患者最初接受了为其4周的relatlimab、纳武单抗以及两种药物联合治疗,这就能使其分析每一种治疗方案的效果。
此前多项研究结果表明,单独使用relatlimab并不能改善机体的抗肿瘤免疫力,但当与纳武单抗联合使用后才能有效,通过揭示relatlimab如何影响机体的T细胞反应,这项最新研究结果表明,这种疗法或能与其它改善机体免疫反应的免疫疗法结合。研究者Bruno说道,我们对这项研究感到特别兴奋,因为研究分析是在此前没有接受过免疫疗法的患者机体的样本中进行的,这就能促使我们评估LAG3和PD1单独和联合使用对患者机体肿瘤所产生的影响效应,同时也能进一步帮助理解患者所接受的智能免疫疗法组合,只在改善治疗疗效。
在第二项研究中,研究人员利用经过遗传工程化改造的小鼠进行研究,以便其机体中CD8+ T细胞并不会产生PD1、LAG3或两者兼有。在黑色素小鼠模型中,相比缺乏PD1或LAG3的T细胞相比,缺乏两种免疫检查点的T细胞会增强对肿瘤的清除并改善小鼠的生存率,这就增强了临床试验的结果,此外,研究人员还揭示了PD1和LAG3如何协同作用从而阻碍机体抗肿瘤免疫力背后的分子机制。
发表在Cell杂志上的另一项研究中,研究者Vignali作为其中的合作者,他们所得到的研究结果与上述研究结果一致,同时还提供了关于LAG3和PA1如何以不同的方式促进T细胞耗竭的新见解。综上,这三篇研究报告提供了LAG3和PD1如何单独发挥功能以及联合作用背后的分子机制,并强调了利用其进一步进行临床研发的新机会。(生物谷Bioon.com)
参考文献:
Shin Foong Ngiow,Sasikanth Manne,Yinghui Jane Huang, et al. LAG-3 sustains TOX expression and regulates the CD94/NKG2-Qa-1b axis to govern exhausted CD8 T cell NK receptor expression and cytotoxicity, Cell (2024). DOI:10.1016/j.cell.2024.07.018
Lawrence P Andrews,Samuel C Butler, Jian Cui, et al. LAG-3 and PD-1 synergize on CD8+ T cells to drive T cell exhaustion and hinder autocrine IFN-γ-dependent anti-tumor immunity, Cell (2024). DOI: 10.1016/j.cell.2024.07.016
Anthony R. Cillo,Carly Cardello,Feng Shan, et al. Blockade of LAG-3 and PD-1 leads to co-expression of cytotoxic and exhaustion gene modules in CD8+ T cells to promote antitumor immunity, Cell (2024). DOI: 10.1016/j.cell.2024.06.036
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


