有机:Science后再发Nat. Chem.:17个结构多样性pleuromutilin类抗生素的全合成
来源:CBG资讯 2022-11-01 13:25
最近,美国耶鲁大学(Yale University)Seth B. Herzon教授课题组报道了一种通用的全合成路线,能够实现17个结构多样性pleuromutilins类抗生素的高效合成。
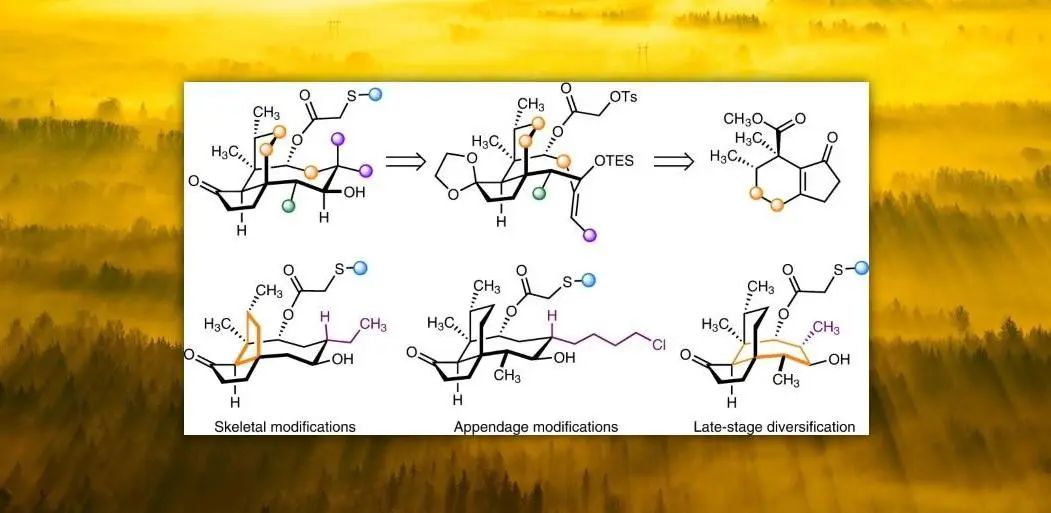
导读:
最近,美国耶鲁大学(Yale University)Seth B. Herzon教授课题组报道了一种通用的全合成路线,能够实现17个结构多样性pleuromutilins类抗生素的高效合成。该全合成路线采取的关键反应包括:1)以乙烯基Wolff重排为关键反应构建C9位季碳立体中心;2)以非对映选择性丁炔基化构建C14位二级醇羟基;3)以exo-选择性镍催化还原环化构建8元环。作者还通过生物活性研究对构效关系进行了评估。相关研究成果发表在近期的《自然-化学》上(Nat. Chem. DOI: 10.1038/s41557-022-01027-7)。
背景介绍(Fig. 1):
耐药性细菌病原体的快速出现使得新颖抗菌药物的化学全合成显得愈来愈重要。截短侧耳素类抗生素pleuromutilin(1)是一种三环二萜类抗生素,是从Clitopilus属担子菌中分离出的真菌代谢产物(Fig. 1a)。研究显示该二萜类化合物对革兰氏阳性菌具有强效的抑制活性,且不易与其它蛋白质合成抑制剂产生交叉耐药性。Pleuromutilin类抗生素也存在缺陷,包括:1)口服利用度低;2)C8位易被细胞色素P450酶氧化而导致失活。因此,合成更多pleuromutilin类抗生素并进行生物活性研究具有重要意义。
瑞他帕林retapamulin(3)和来法莫林lefamulin(4)是两个成功的pleuromutilin类抗生素临床半合成新药(Fig. 1a)。但是,相比研究广泛的四环素类、大环内酯类、链阳霉素类和林可酰胺类抗生素,pleuromutilin类抗生素的研究不够深入。Sorensen组在2011年报道了多种重要的pleuromutilin类衍生物的制备,但这些衍生物只具有中等的生物活性(Chem. Sci. 2011, 2, 1258–1261)。耶鲁大学Seth B. Herzon课题组曾在2017年报道了(+)-pleuromutilin(1)和12-epi-pleuromutilin(2)的全合成(Fig. 1b, Science 2017, 356, 956)。但该合成路线也存在局限性,包括:1)6参与的Nagata氢氰化反应没有普遍性;2)8和9的偶联反应底物普适性差;3)构建好8元环后再构建C14位季碳立体中心挑战性极大;4)路线效率不高。为此,该课题组在最近报道了一种新的通用合成路线,能够解决存在的这些问题。
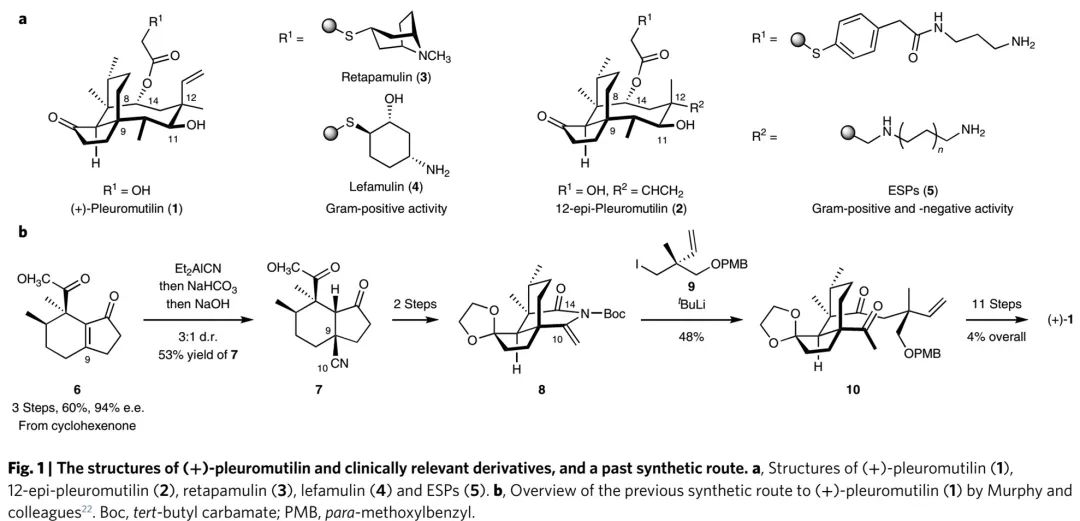 (Fig. 1,来源:Nat. Chem.)
(Fig. 1,来源:Nat. Chem.)
17个衍生物的全合成(Fig. 2-4):
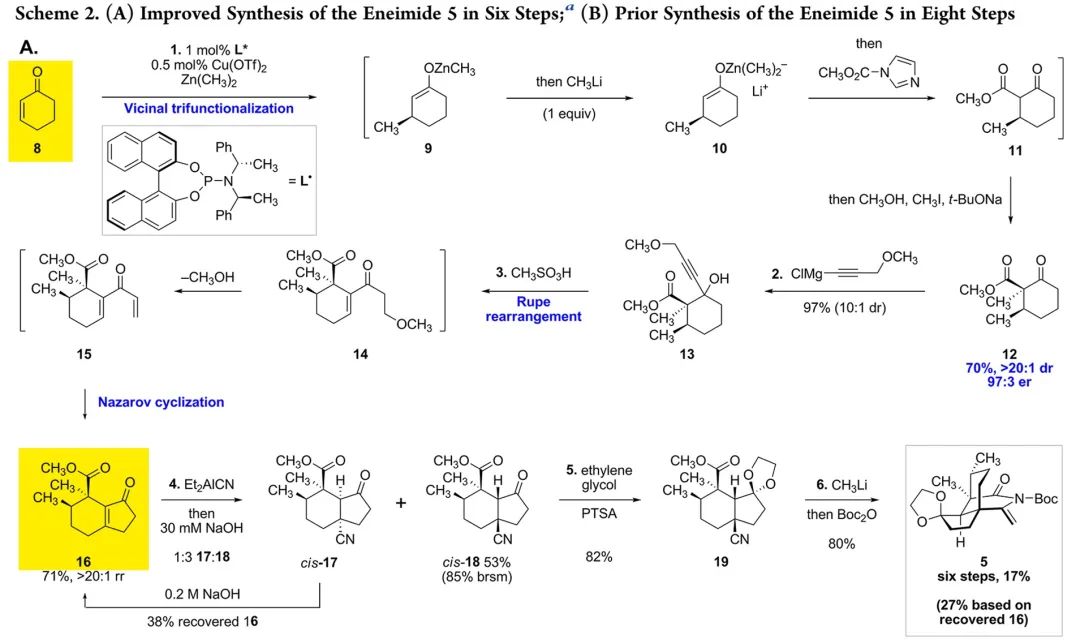 (图1, 来源:Org. Lett. 2017, 18, 4980–4983)
(图1, 来源:Org. Lett. 2017, 18, 4980–4983)
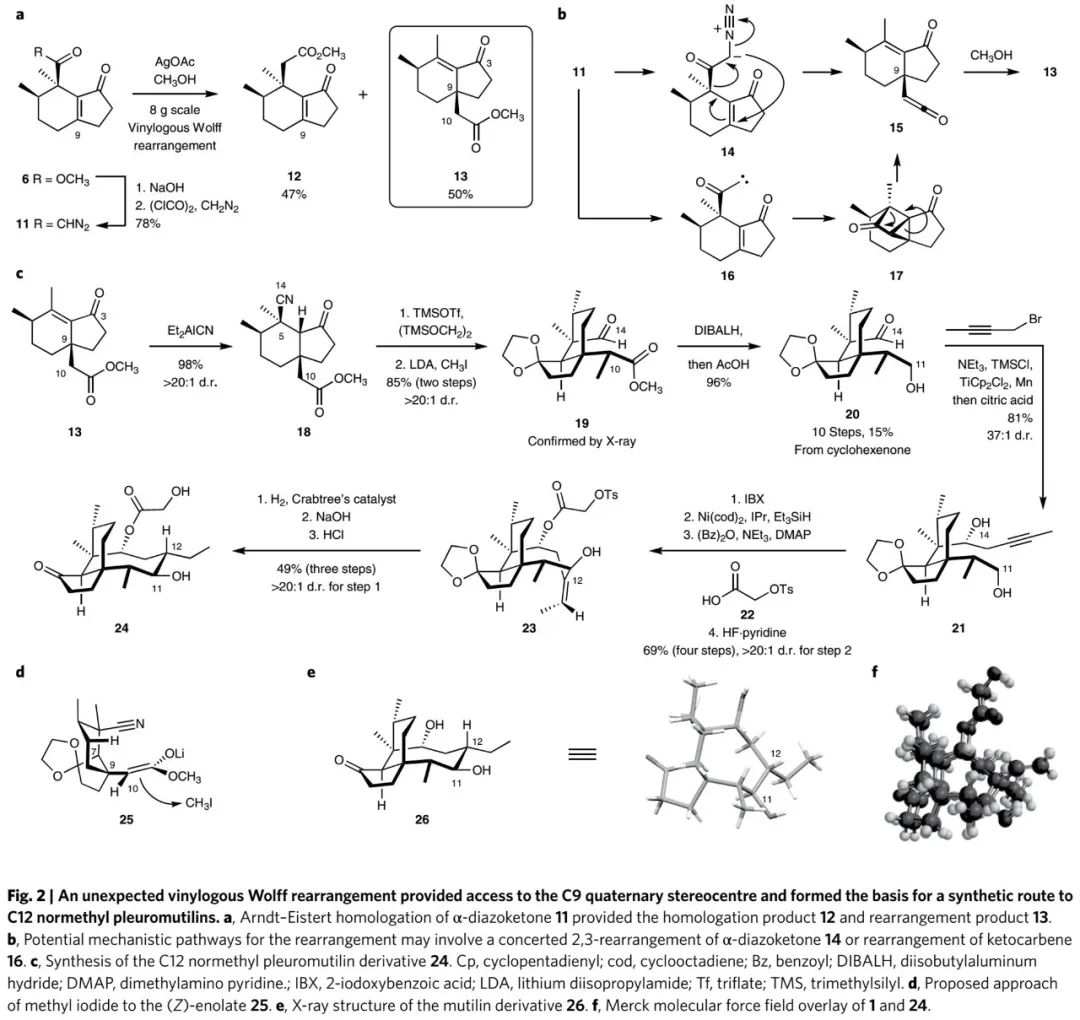 (Fig. 2,来源:Nat. Chem.)
(Fig. 2,来源:Nat. Chem.) (Tabel S1 in SI, 来源:Nat. Chem.)
(Tabel S1 in SI, 来源:Nat. Chem.)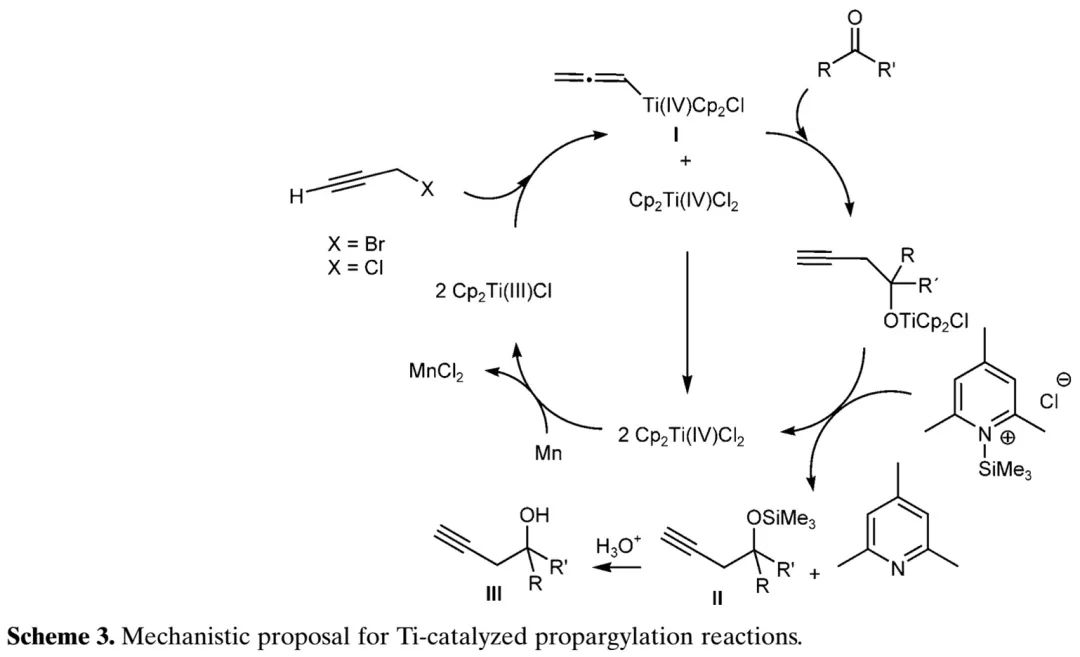 (图2, 来源:Adv. Synth. Catal. 2009, 351, 2295–2300)
(图2, 来源:Adv. Synth. Catal. 2009, 351, 2295–2300)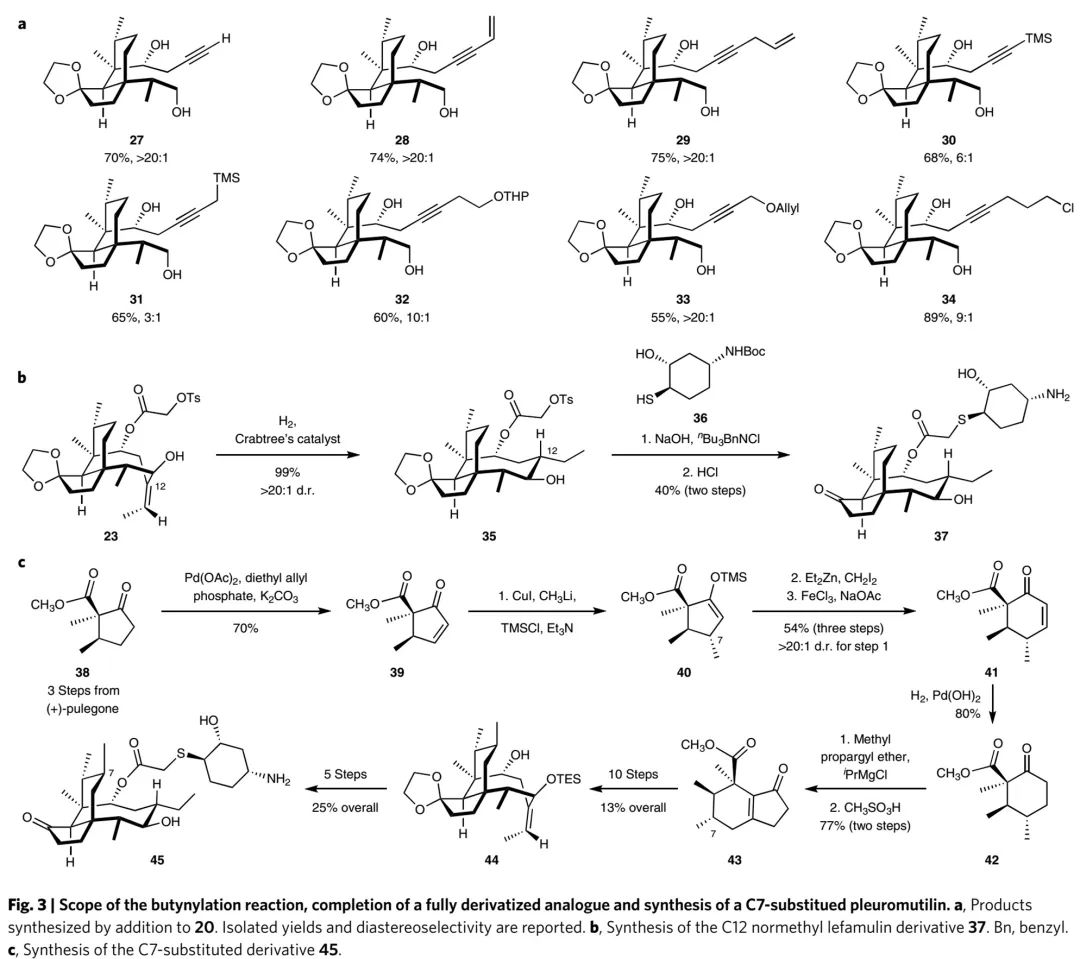 (Fig. 3,来源:Nat. Chem.)
(Fig. 3,来源:Nat. Chem.)
Pleuromutilin类抗生素易发生C8位代谢氧化而失活,因此作者计划对其核心骨架中6元环进行结构修饰,包括:1)6元环C7位加烷基取代基(Fig. 3c);2)6元环缩环至5元环或8元环缩环至7元环(Fig. 4),以阻碍C8位代谢氧化的发生。所修饰的骨架化合物再经新开发的通用合成路线,可以高效转化成难以通过半合成获取的pleuromutilin骨架修饰类衍生物。
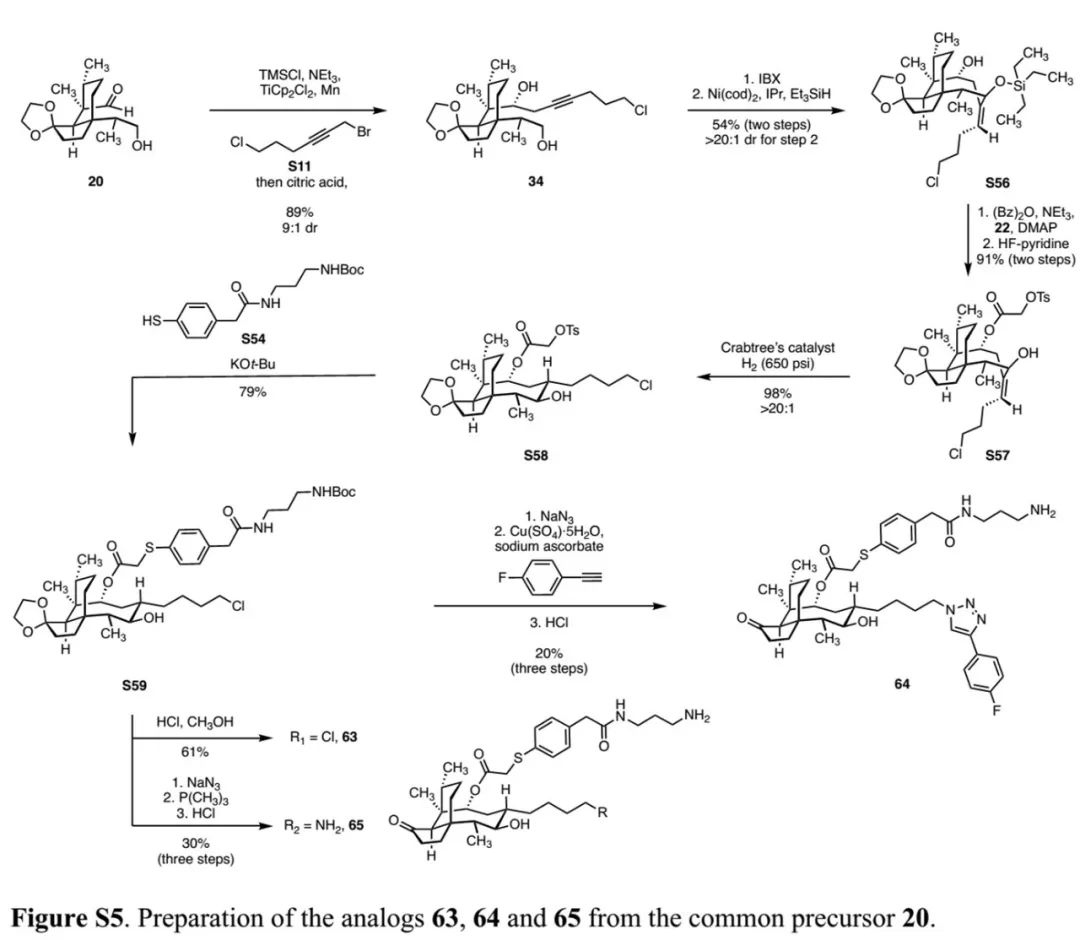
如Fig. 3c所示,以(+)-pulegone为原料,经3步反应转回为已知物38。38经去饱和化反应得到烯酮39,39经硅促进、铜催化的1,4-加成转化成单一构型产物40。40经环丙烷化-氯化铁促进的扩环反应-加氢还原反应得到化合物42。42经如图1所示的5元环合成方式,转化成双环烯酮化物43。以Fig. 2a-2b和Fig. 3b中开发出的通用合成路线为基础,43经类似的15步反应成功转化成lefamulin的C7位甲基化衍生物45,详细合成路线见Fig. S1 in SI。
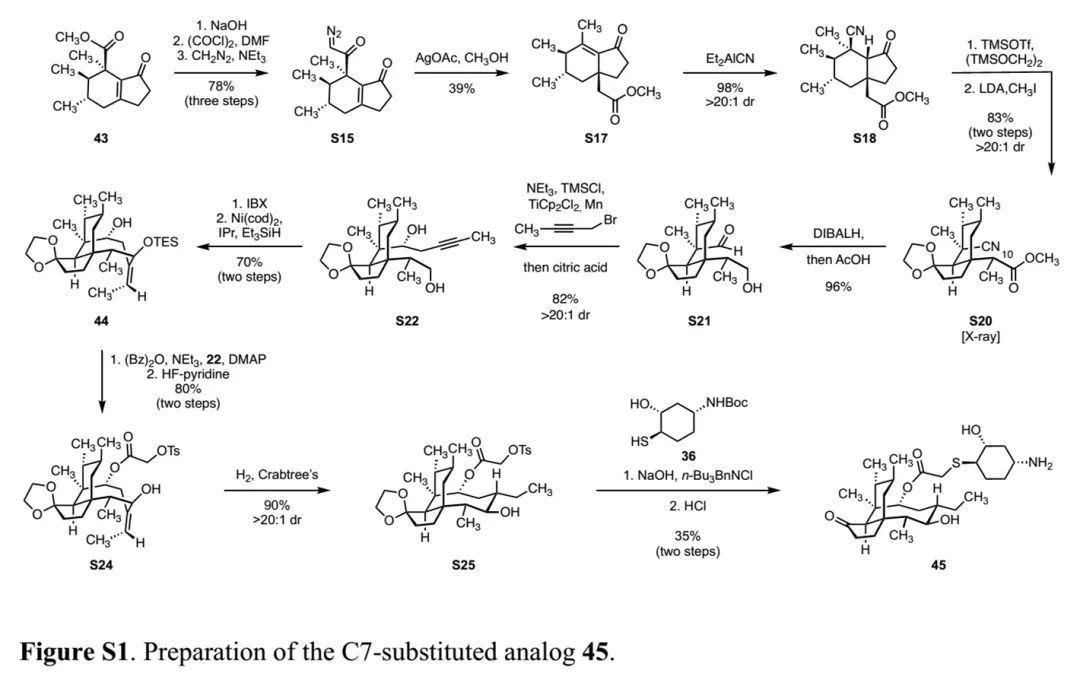 (Fig. S1 in SI,来源:Nat. Chem.)
(Fig. S1 in SI,来源:Nat. Chem.)
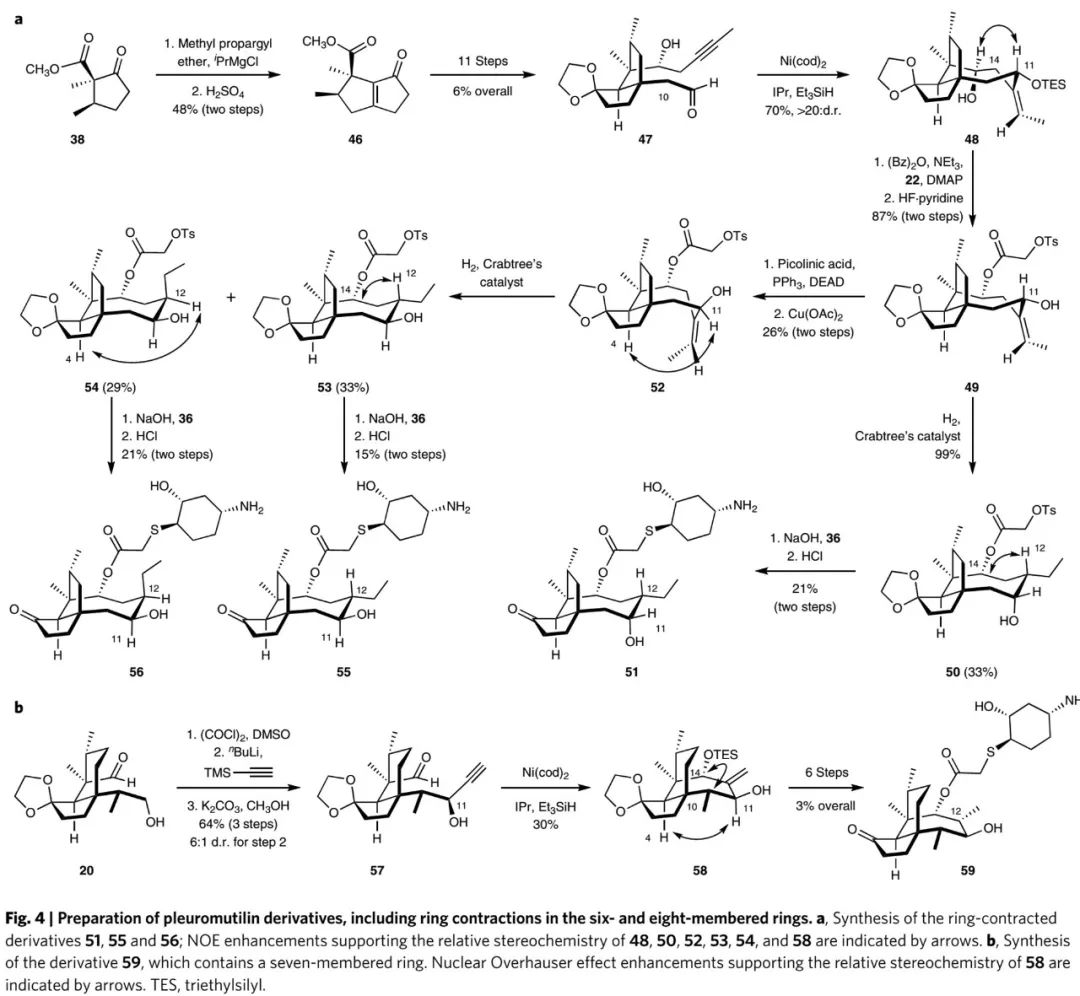 (Fig. 4,来源:Nat. Chem.)
(Fig. 4,来源:Nat. Chem.)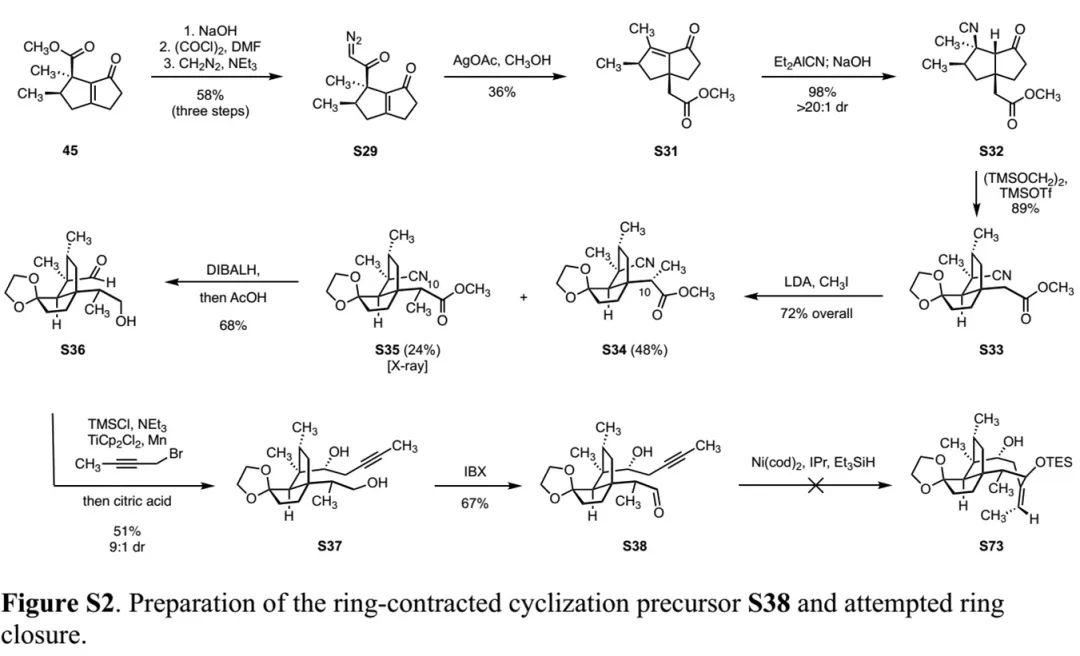 (Fig. S2 in SI,来源:Nat. Chem.)
(Fig. S2 in SI,来源:Nat. Chem.)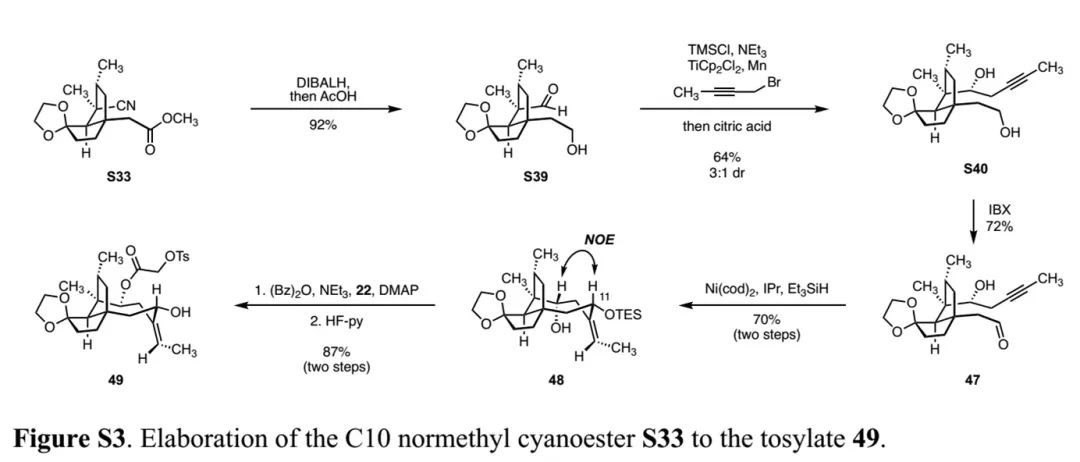 (Fig. S3 in SI,来源:Nat. Chem.)
(Fig. S3 in SI,来源:Nat. Chem.)
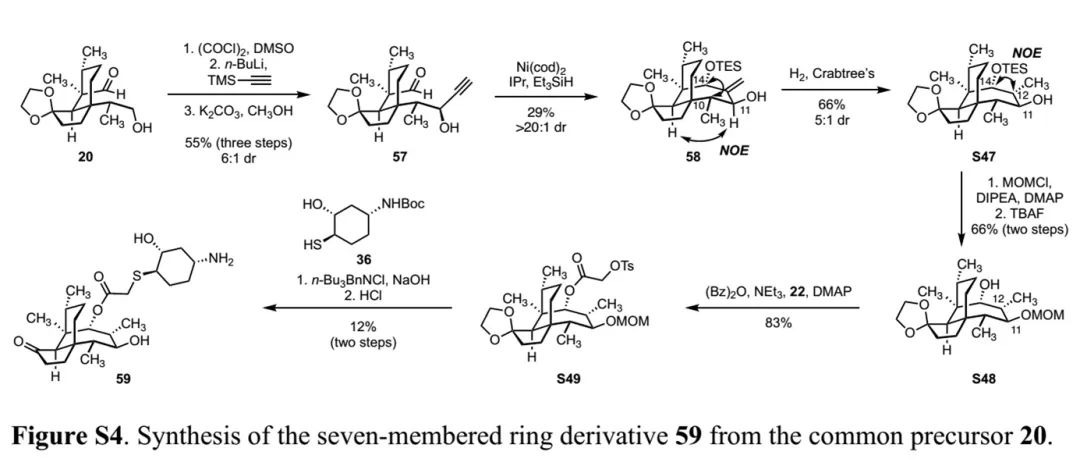 (Fig. S4 in SI,来源:Nat. Chem.)
(Fig. S4 in SI,来源:Nat. Chem.)
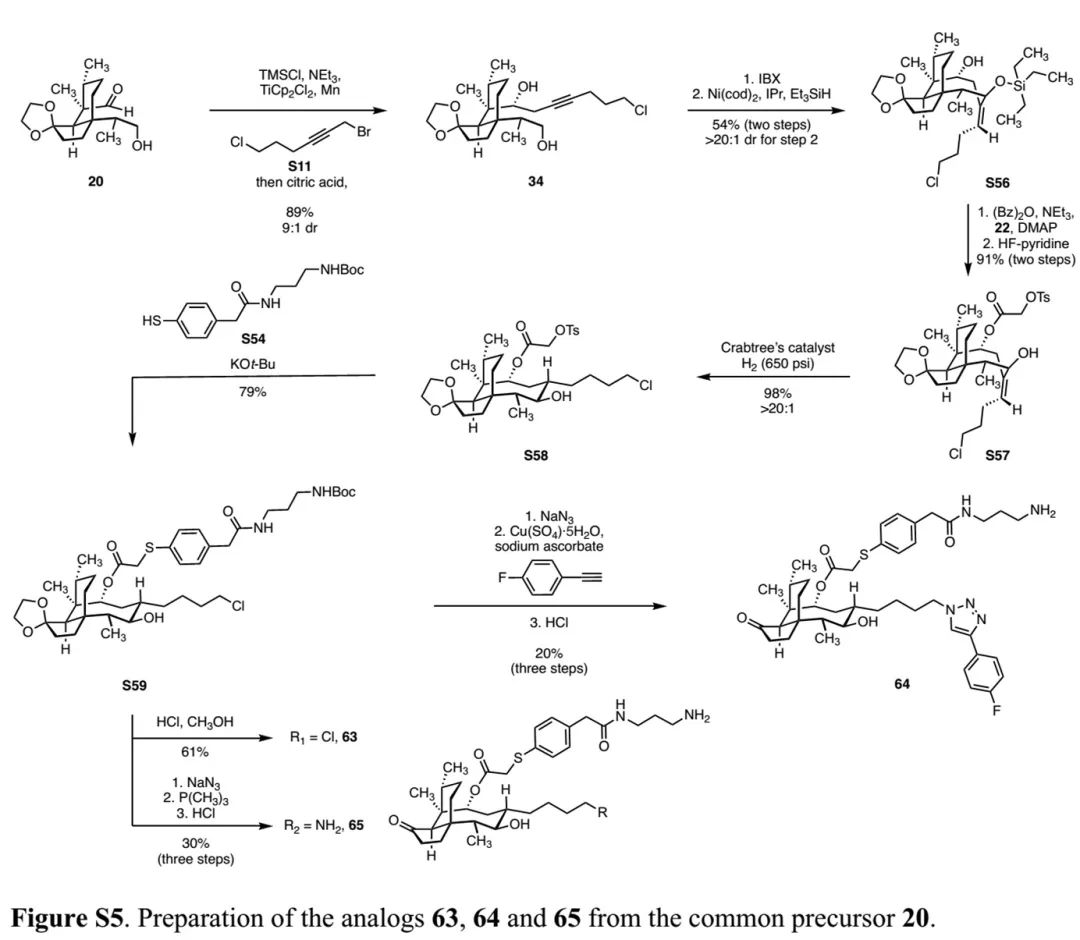 (Fig. S5 in SI,来源:Nat. Chem.)
(Fig. S5 in SI,来源:Nat. Chem.)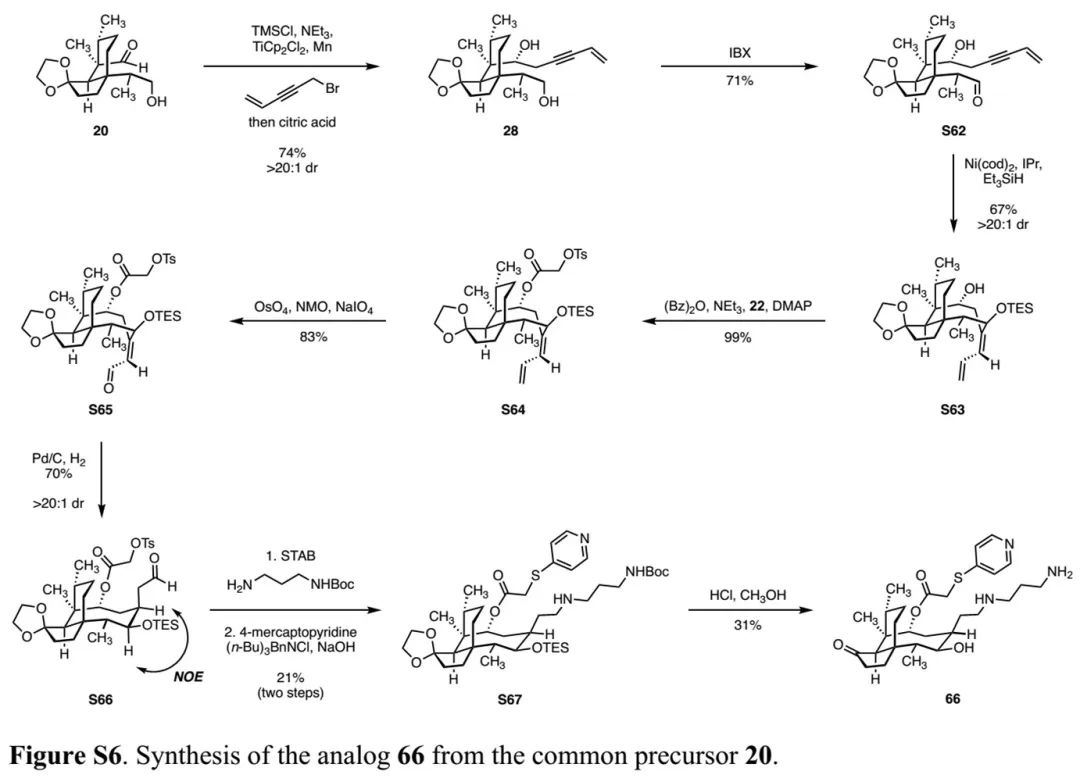 (Fig. S6 in SI,来源:Nat. Chem.)
(Fig. S6 in SI,来源:Nat. Chem.)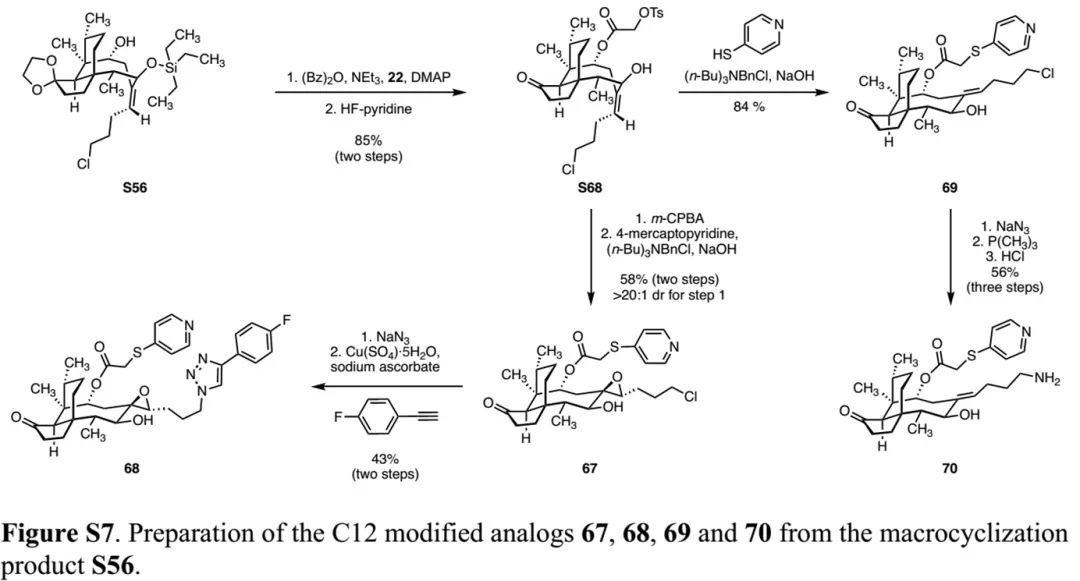 (Fig. S7 in SI,来源:Nat. Chem.)
(Fig. S7 in SI,来源:Nat. Chem.)
生物活性研究(Fig. 5):
最后,作者开展生物活性研究和构效关系评估。研究的衍生物包括:lefamulin(4)、可以通过半合成得到的衍生物60-62、新合成的衍生物63-71、37、45、51、55、56、59、24、72。通过如Fig. 5所示生物活性研究,作者得出如下结论:1)C12位基团为直立键会降低生物活性(66);2)改变8元环的构象会影响细胞吸收或核糖体结合,使衍生物不具有生物活性(69-70);3)C7位甲基化衍生物45和缩环衍生物51、55、56、59也基本都无生物活性;4)不含极性侧链的衍生物24也无活性,证明衍生物含有极性侧链的重要性。
 (Fig. 5,来源:Nat. Chem.)
(Fig. 5,来源:Nat. Chem.)
总结:
总之,Seth B. Herzon教授课题组通过一种通用全合成路线,高效合成17个结构多样性pleuromutilins类抗生素,并通过生物活性研究确定构效关系。作者后期将进一步开展结构修饰,以期解决长期存在的口服利用低和代谢稳定性问题。
论文信息:
Total synthesis of structurally diverse pleuromutilin antibiotics
Olivia Goethe, Mikaela DiBello and Seth B. Herzon*
Nat. Chem. DOI: 10.1038/s41557-022-01027-7
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


