Cell:高璞/高光侠/张立国团队揭示EB病毒致癌蛋白LMP1的组装与激活机制
来源:生物世界 2024-07-17 10:02
该研究报道了EBV关键致癌蛋白LMP1自组装和组成性激活的分子基础,为EBV-LMP1诱发致癌信号和调节免疫应答等生物学功能提供了新的理论模型。
中国科学院生物物理所高璞、高光侠、张立国合作团队在 Cell 期刊发表了题为:Assembly and activation of EBV latent membrane protein 1 的研究论文,该团队经过6年多的科研攻关,揭开了EBV关键致癌蛋白LMP1自组装和组成性激活的神秘面纱。
该研究发现,LMP1以一种全新且与此前猜测完全不同的机制进行寡聚自组装,并通过巧妙方式高效招募下游因子,从而激活和维持致病信号活化。另外,研究中发现的新机制和新界面,也为此前一些不清楚的现象提供了精确解释,并有望直接助力LMP1靶向干预策略的开发。

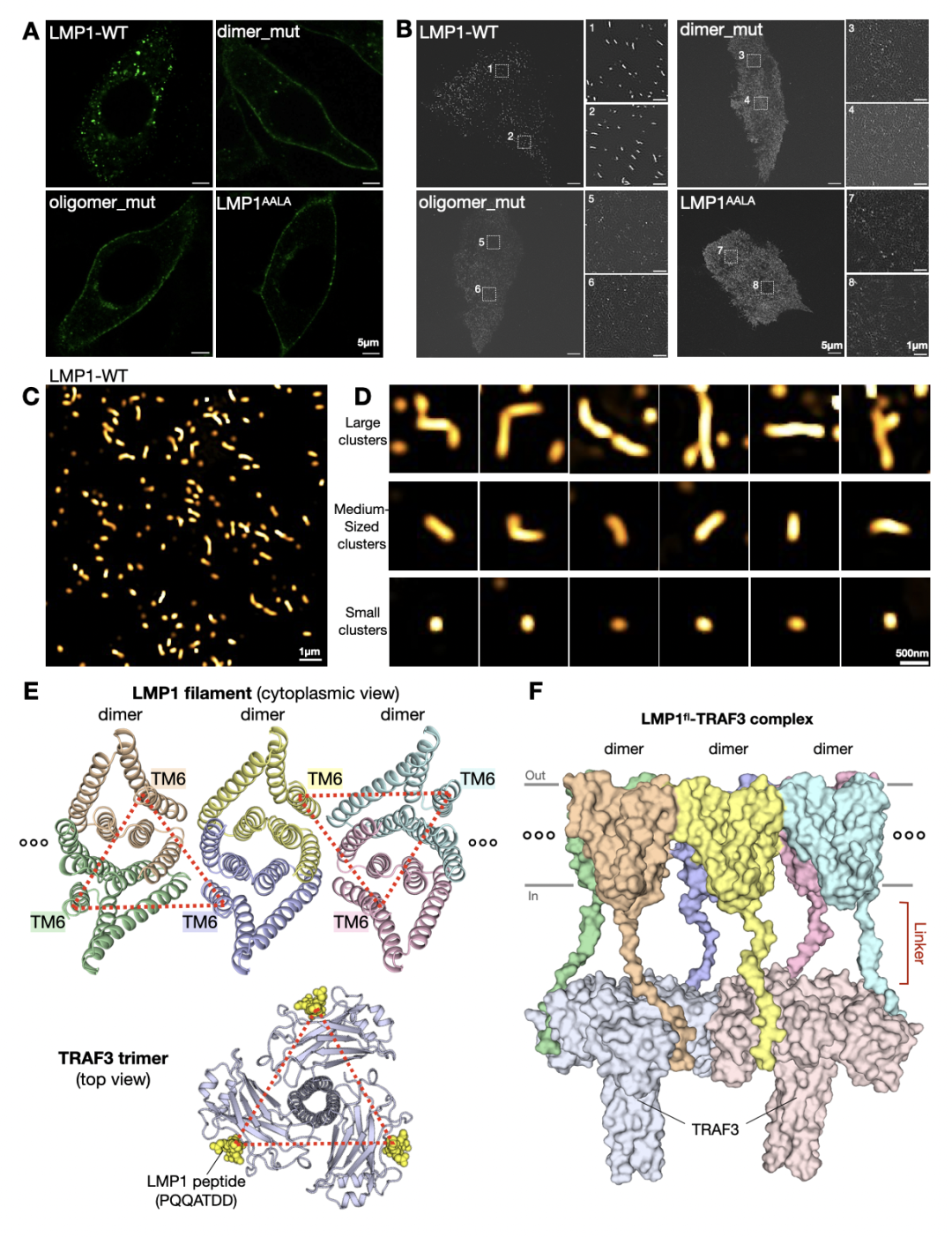
研究团队首先利用共聚焦显微镜进行细胞成像,发现LMP1在生理表达水平下会在膜上呈现为明显的聚集形态。进一步的超分辨成像表明,LMP1的聚集是一种宽度较为固定但长度不均一的细条状结构。这些结果表明LMP1可在膜上组装成有趣的聚集,但其分子层面的细节仍不清楚。
为回答这一问题,研究团队计划解析LMP1在不同组装状态下的精细结构。然而,这一目标在过去近40年的研究中已被证明非常具有挑战性,主要是因为:1)性质良好的LMP1蛋白很难大量制备;2)LMP1核心跨膜区仅~20 KDa,且几乎无可识别的稳定水溶区。
经过大量尝试,研究团队解决了LMP1难表达、难纯化的问题,生化分析也提示LMP1在溶液中存在不同聚集状态。为辅助结构解析,研究团队进一步开展了系统性LMP1抗体筛选,获得了能够稳定结合LMP1跨膜区的鼠源单抗。通过抗体辅助策略,研究团队成功解析了LMP1两种意想不到的聚集态结构:轴对称二聚体和filament状高聚体。LMP1单体以一种全新的方式进行跨膜区折叠,进而通过反向平行叠合形成稳定的二聚体结构;LMP1二聚体是其进行更高级组装的基本单元,多个二聚体以“side-by-side”方式自组装形成filament状高聚结构。重要的是,这些高分辨率的结构信息,恰好符合活细胞成像所观测到的独特聚集形态,从而在不同分辨率尺度上揭示了LMP1的膜上聚集机制。
值得一提的是,由于目前PDB数据库中尚无任何LMP1的同源结构,LMP1多种状态(单体、二体及寡聚体)的真实结构均与AlphaFold2/3等工具的预测结果完全不同。而且,这种不同不仅体现在结构折叠的巨大差异,更为严重的是预测结果的基本拓扑学走向也完全错误。这提示在没有同源结构训练的情况下,我们对预测结构的使用需格外谨慎。从另一个角度来说,该研究中获得的LMP1多种聚集状态的真实结构,也为后续预测训练提供了全新且独立的折叠方式及组装模式。
LMP1在膜上的组装和聚集
为进一步明确LMP1的功能形式,研究团队对二聚体和寡聚体界面分别进行了系统突变,发现其均会破坏LMP1在活细胞中的膜聚集形态,且均能阻断下游信号通路活化。这既证明了LMP1分子间互作的重要性,也明确了LMP1的寡聚filament结构才是其真正的激活状态。超分辨成像结果表明,LMP1在膜上的自发filament状聚集可包含几十至数百个LMP1二聚体单元。LMP1的这种聚集在很低蛋白水平下即可发生,且随着LMP1含量增加,多聚体的数量、强度和长度均呈现显著增长。这也是首次在较低表达水平下(类似病毒感染的表达水平),系统性观察到LMP1在膜上的超分辨动态聚集和组装。
有趣的是,作为LMP1的功能相关蛋白,宿主膜受体CD40的激活需依赖其配体介导的三聚体组装;而且,LMP1和CD40共同的下游信号因子TRAF蛋白,也是以三聚体形式发挥功能。因此,长期以来领域里普遍推测LMP1也应该是采用三聚体的方式来组装,这样才能更好的与下游因子进行衔接。而LMP1却是以二聚体为单元进行“side-by-side”方式的filament自组装,那么其是如何有效协调信号转导的呢?
研究团队通过细致分析,发现二聚体单元中的两个LMP1的C端,可以和邻近二聚体中一个LMP1的C端,在空间上呈现近似等边三角行的巧妙排列。由于C端延伸的水溶区负责招募下游因子,因此这种filament自组装方式,结构上等价于多个LMP1“三聚体”平行密集排列,从而能够比CD40更高效招募下游因子和进行信号转导。此前研究也证实,如果将CD40 负责下游因子招募的C端水溶区连接到LMP1的跨膜区上,那么这种嵌合体蛋白的信号激活能力要显著强于原始的CD40。同时,研究团队也通过生化手段在体外重组了LMP1与TRAF复合体,利用电镜直接观察到LMP1的filament聚集确实可以同时招募多对TRAF三聚体。LMP1这种多位点且组成性的下游蛋白招募、激活方式,极大促进了信号转导强度,并有效维系了持续的增殖、癌变信号。

CD40与LMP1的不同激活机制
综上所述,该研究报道了EBV关键致癌蛋白LMP1自组装和组成性激活的分子基础,为EBV-LMP1诱发致癌信号和调节免疫应答等生物学功能提供了新的理论模型。
另外,该研究也为开发针对EBV相关疾病的干预手段提供了新思路,例如:
1)鉴于LMP1二聚和寡聚对其功能至关重要,靶向这两个全新的互作界面可能是一种有效干预策略;
2)LMP1单体极小的胞外区导致其极低的免疫原性,而本研究发现的寡聚组装为LMP1胞外区抗体的开发提供了全新表位信息;
3)二聚体和多聚体状态的精细结构信息,为计算和设计靶向LMP1的结合分子提供了多个潜在靶向界面。
中国科学院生物物理所助理研究员黄嘉丰和助理研究员张晓林为论文共同第一作者;高璞研究员、高光侠研究员和张立国研究员为共同通讯作者。生物物理所李栋研究员团队在超分辨成像方面提供了重要帮助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


