5月 Nature杂志不得不看的重磅级亮点研究!
来源:生物谷原创 2023-05-31 22:57
时间匆匆易逝,转眼间5月份即将结束,在即将过去的5月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
时间匆匆易逝,转眼间5月份即将结束,在即将过去的5月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
【1】Nature:利用新型机器学习算法CEBRA解码小鼠大脑的动态信号
doi:10.1038/s41586-023-06031-6
是否有可能仅根据大脑信号就完全重建某人所看到的东西?答案是否定的,还没有。近日,一篇发表在国际杂志Nature上题为“Learnable latent embeddings for joint behavioural and neural analysis”的研究报告中,来自瑞士洛桑联邦理工学院的研究人员在这个方向上迈出了重要的一步:他们引入了一种新的算法来建立人工神经网络模型,以令人印象深刻的准确度来捕捉大脑的动态。这种根植于数学的新型机器学习算法被称为CEBRA,可学习神经代码中的隐藏结构。
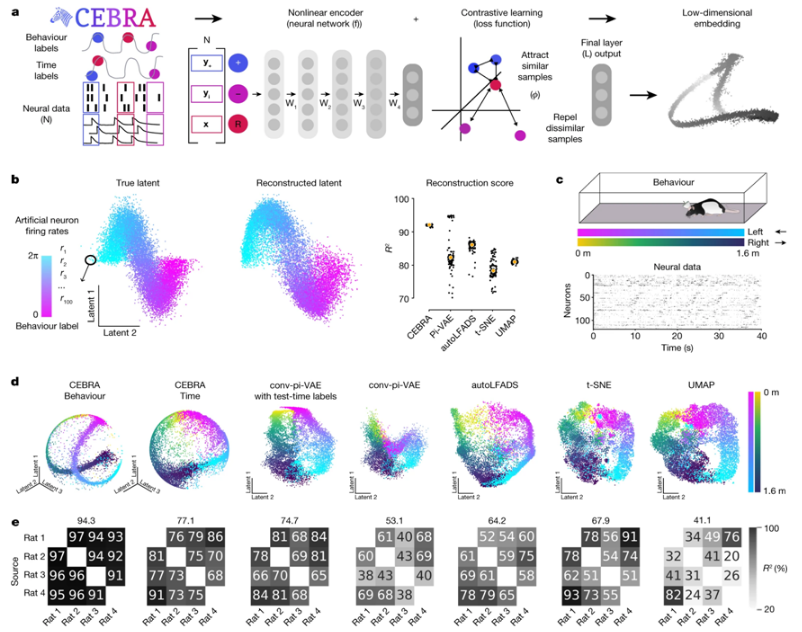
使用CEBRA进行一致的和可解释的嵌入
图片来源:Nature, 2023, doi:10.1038/s41586-023-06031-6
这些作者的演示很清晰。一只小鼠观看一部20世纪60年代的黑白电影片段,其中一个男人跑向一辆汽车并打开后备箱。在另一个屏幕上,人们看到的是CEBRA计算出来这部电影的重建。这种由CEBRA构建的电影几乎与原作完全吻合,只是有一些怪异的扭曲,就好像你刚刚在《黑客帝国(Matrix)》中看到了一只虫子。CEBRA从原始神经数据中学习到什么信息,可以在训练后通过解码进行测试---这是一种用于脑机接口(brain-machine-interface, BMI)的方法,他们发现他们可以从这种模型中解码出小鼠在观看电影时看到的内容。但CEBRA并不限于视觉皮层神经元,甚至是大脑数据。他们的研究还表明,它可以用来预测灵长类动物的手臂运动,并重建大鼠在竞技场上自由奔跑时的位置。
研究者表示,这项研究只是朝着神经技术中需要的有理论支持的算法以实现高性能的脑机接口迈出了一步。为了学习小鼠视觉系统中的潜伏(即隐藏)结构,CEBRA在最初的训练阶段将大脑信号和电影特征进行映射后,可以直接从大脑信号中预测未观看的电影帧;这些用于视频解码的数据是通过艾伦研究所(Allen Institute)公开获取的。这些大脑信号是通过插入小鼠大脑视觉皮层区域的电极探针或者使用光学探针---涉及使用经过基因改造后让激活的神经元发出绿色荧光的小鼠---直接测量大脑活动获得的。在这种训练阶段,CEBRA学习将大脑活动映射到特定的电影帧。考虑到小鼠的这一大脑区域大约由50万个神经元组成,CEBRA在视觉皮层中不到1%的神经元上表现良好。
【2】Nature:靶向PD-L2–RGMb有望增强克服肠道菌群相关的免疫治疗抵抗力,增强癌症免疫疗法的疗效
doi:10.1038/s41586-023-06026-3
癌症免疫疗法已经改变了许多类型癌症的治疗。然而,由于仍然不甚明了的原因,并非所有患者都能从这些强大的疗法中获得同样的益处。近日,一篇发表在国际杂志Nature上题为“Targeting PD-L2–RGMb overcomes microbiome-related immunotherapy resistance”的研究报告中,来自美国哈佛医学院和丹娜-法伯癌症研究所的研究人员指出影响癌症免疫疗法治疗结果的一个有力因素似乎是患者的肠道菌群---生活在人类肠道中的数万亿个微生物。
这项研究是在小鼠身上完成的,它指出了肠道微生物如何增强身体对一种称为称为PD-1检查点阻断疗法的常见免疫疗法的反应。目前,PD-1检查点阻断疗法用于治疗25种形式的癌症。该研究发现,特定的肠道细菌可以影响两种免疫分子---PD-L2和RGMb---的活性,以及它们之间的相互作用。该研究还表明,阻断其中任何一种分子的活性或它们之间的相互作用,可以增强对癌症免疫疗法的反应,优化身体检测和摧毁癌细胞的能力。
研究者Arlene Sharpe说道,我们的研究表明,用阻断PD-L2与RGMb相互作用的抗体进行治疗可以解除对抗癌T细胞的抑制,使得它们能够根除肿瘤。这项新的研究还确定了RGMb分子是以前未知的破坏身体发现和摧毁肿瘤能力的帮凶。RGMb主要以其在神经系统发育中的作用而闻名,也在抗癌的T细胞表面上发现。然而,在此之前,没有人知道它在调节T细胞对癌症免疫疗法的反应方面发挥了作用。
这些作者指出,如果在人类身上得到重现,这些发现可以为开发改善免疫疗法治疗结果的疗法提供信息。研究者Joon Seok Park表示,我们的发现为一个复杂的难题提供了关键的线索,并以此提出了增强癌症免疫疗法效力和改善患者预后的具体方法。我们提出了一种新的方法,通过了解帮助我们的免疫系统对抗癌症的肠道细菌来克服这种疾病对当前癌症免疫疗法的抵抗。
【3】Nature:揭示最小的可编程核酸酶TnpB的三维结构
doi:10.1038/s41586-023-05826-x
近日,一篇发表在国际杂志Nature上题为“TnpB structure reveals minimal functional core of Cas12 nuclease family”的研究报告中,来自立陶宛维尔纽斯大学生命科学中心等机构的科学家们通过利用低温电镜(cryo-EM)确定了TnpB的结构。CRISPR-Cas核酸酶,如Cas9或Cas12,也被称为基因剪刀,已经彻底改变了基因组编辑领域。它们能够精确编辑基因组,并校正致病突变。然而,Cas9或Cas12的大小限制了利用已用于基因治疗的腺相关病毒(AAV)将它们递送到靶细胞中。
在之前的一项研究中,?ik?nys团队报告了一类新的可编程的核酸酶---TnpB---的发现,TnpB与称为转座子的可移动遗传元件有关(Nature, 2021, doi:10.1038/s41586-021-04058-1)。他们证实TnpB是最小的可编程核酸酶,可用于有效的基因编辑;然而,它的结构组织和作用机制仍然未知。?ik?nys教授说,“这项新的研究是长期不懈努力的结果,它展示了立陶宛科学家在生命科学领域的潜力,以及他们成为该领域领导者的能力。这项研究揭示了TnpB基因剪刀的结构和机制,为进一步有针对性地改造TnpB复合物奠定了基础。”
在这项新的研究中,这些作者使用低温电镜来确定最小的可编程核酸内切酶TnpB的三元结构,这种结构与生化实验数据一起解释了TnpB基因剪刀如何精确识别和切割DNA靶标。
【4】Nature:构建出第一种人类肠道病毒crassvirus的结构图谱
doi:10.1038/s41586-023-06019-2
一类称为crassvirus(也被称为crassvirales、噬菌体、crass样噬菌体)的病毒是人类肠道中最丰富的一组病毒,它们在塑造肠道微生物组、影响健康和疾病方面可以发挥重要作用。近日,一篇发表在国际杂志Nature上题为“Structural atlas of a human gut crassvirus”的研究报告中,来自爱尔兰科克大学等机构的研究人员完成了有史以来第一种称为ΦcrAss001的crassvirus的结构图谱。
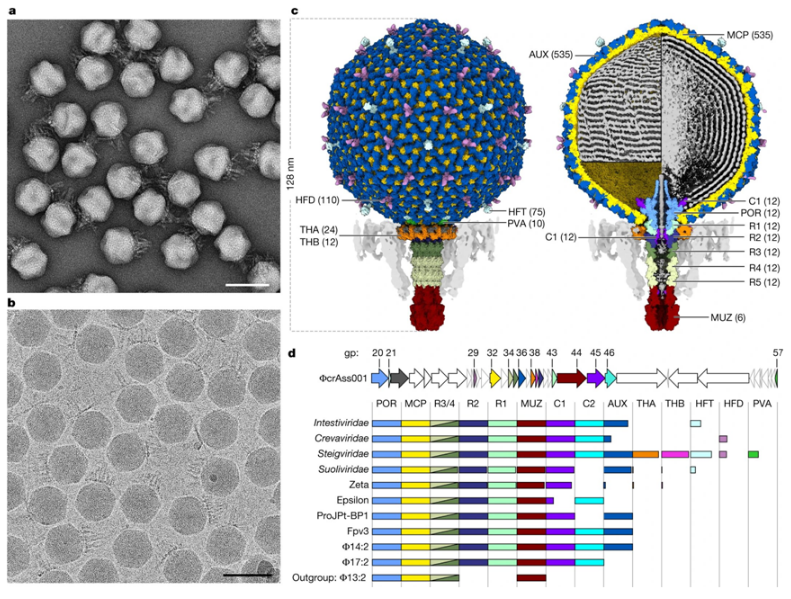
ΦcrAss001病毒颗粒的结构和功能分配
图片来源:Nature, 2023, doi:10.1038/s41586-023-06019-2
这些作者首次在实验室中培养了一种crassvirus,并开发出了这种肠道病毒的详细原子级结构。这类肠道病毒被认为在塑造人类微生物组的组成和功能方面发挥着作用。在实验室中培养它们的能力,加上这个新构建的结构图谱,将促进探究它们在肠道微生物组功能和人类健康中的作用所需的研究。关键的突破包括确定这种crassvirus病毒携带的多种货物蛋白的存在,包括找到一种同时占据该病毒头部和尾部的蛋白。这一发现使得他们能够预测该病毒如何将它的DNA注入它的细菌宿主的机制。
这些作者还发现了一种新的蛋白折叠,它起到了“看门人”的作用,控制着病毒颗粒的进出。此外,他们如今能够为之前被认为是假设的病毒基因分配功能。研究者Colin Hill教授说,“这类病毒可能是与人类相关的最丰富的生物实体,然而我们在不到十年前才发现它们,所以这一切都相当新颖,非常令人兴奋。培养病毒是一个重要的研究里程碑和突破。从本质上讲,你必须能够培养它才能了解它,一旦我们在APC 微生物组研究所开发了培养这种病毒的能力,我们就能够联系约克大学的同事,帮助研究它的所有精致细节。最终的结构确实很漂亮,是对APC 微生物组研究所和约克大学多年来精心工作的恰当回报。
【5】Nature:揭示铜促进炎症产生机制,有望开发抗击炎症和癌症的新疗法
doi:10.1038/s41586-023-06017-4
炎症是一种复杂的生物过程,可以根除病原体并促进受损组织的修复。然而,免疫系统失调会导致炎症不受控制,反而产生病变。炎症也与癌症有关。炎症的分子机制并不完全了解,因此开发针对炎症的新药面临着重大挑战。早在2020年,法国国家科学研究中心研究主任、居里研究所细胞与化学生物学实验室化学生物学团队负责人Raphael Rodriguez博士就对一种名为CD44的膜受体有了新的认识,该膜受体标志着免疫反应、炎症和癌症进展。Rodriquez博士和他的团队发现了CD44有助于将铁输入细胞,引发一系列反应,导致参与这种输入过程的基因被激活。他解释说,“这是一种细胞可塑性现象,我们继续研究,以便探究其他可能被CD44内化的金属,特别是铜。”
如今,一篇发表在国际杂志Nature上题为“A druggable copper-signalling pathway that drives inflammation”的研究报告中,Rodriquez博士和他的同事们达到了一个新的里程碑。他们成功确定了一条涉及铜的可导致巨噬细胞中促炎性基因表达的信号传导通路,其中巨噬细胞存在于所有组织中,在先天免疫中发挥着重要作用。
一旦在巨噬细胞中内化,铜就会进入线粒体(负责细胞呼吸和能量产生的细胞器),在那里它催化NADH氧化为NAD+(某些酶发挥活性所需的分子)。细胞中NAD+的增加使得某些参与产生对表观遗传调节至关重要的代谢物的酶被激活。因此,这些代谢物有助于激活参与炎症的基因。这些作者并没有就此止步,他们还从二甲双胍(metformin)的结构中得到启发,设计了能够与铜结合的分子。通过在急性炎症模型上测试这些新分子,他们发现二甲双胍的一种合成二聚体---LCC-12(也被称为Supformin)---减少了巨噬细胞的激活并减弱了炎症。Rodriguez博士解释说,“我们的研究使我们能够开发一种使细胞代谢机制中的铜化学反应失活从而阻断参与炎症的基因表达的药物原型。”
【6】Nature:个性化的mRNA疫苗在临床试验中或有望治疗人类胰腺导管腺癌
doi:10.1038/s41586-023-06063-y
胰腺导管腺癌在88%的患者中都是致命的,但其所携带的突变衍生的T细胞新抗原(neoantigens)却非常适合进行相关的疫苗开发。近日,一篇发表在国际杂志Nature上题为“Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer”的研究报告中,来自纪念斯隆-凯特琳癌症中心等机构的科学家们通过研究开发了一种新型个体化mRNA疫苗,在临床试验中其或有望帮助抵御胰腺癌的侵袭性形式。
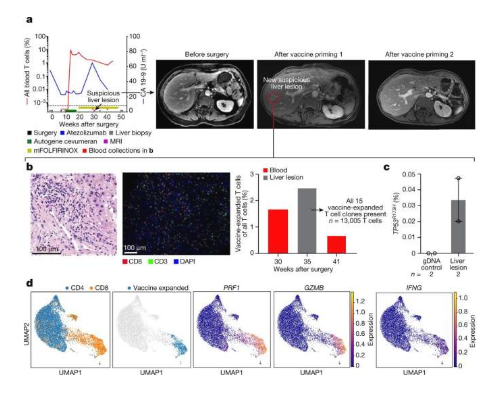
个性化的mRNA疫苗在临床试验中或有望治疗人类胰腺导管腺癌。
图片来源:Nature (2023). DOI:10.1038/s41586-023-06063-y
文章中,研究人员发现,针对胰腺导管腺癌的T细胞或能被单一mRNA疫苗所激活,胰腺癌是人类最致命的一种癌症类型,因为其通常并不会出现疾病症状直到患者进展到晚期,这时候就非常难以治疗了;胰腺导管腺癌尤其具有致死性,其通常会引起大约88%的患者死亡,这就使其成为了美国第三大致命性癌症,被诊断为胰腺导管腺癌的患者通常会有两种选择,即制定死亡计划或接受药物和手术疗法。
近年来,免疫检查点抑制剂作为免疫化疗制剂,已经被证明能有效治疗多种人类癌症,然而,胰腺导管腺癌却并不是其中一种,尽管研究人员目前报告表示,个性化疫苗或许能使这种方法变得可行。免疫疗法能通过识别肿瘤细胞表面的特殊蛋白(新抗原),从而诱导宿主机体免疫系统攻击肿瘤,研究者发现,一种个性化的mRNA疫苗或能激发针对肿瘤细胞表面新抗原的T细胞的攻击作用。
【7】Nature:当缺乏葡萄糖时,胰腺癌细胞利用尿苷作为新的营养物茁壮成长
doi:10.1038/s41586-023-06073-w
近日,一篇发表在国际杂志Nature上题为“Uridine-derived ribose fuels glucose-restricted pancreatic cancer”的研究报告中,来自美国密歇根大学罗杰尔癌症中心等机构的研究人员发现了胰腺癌细胞用来生长的一种新的营养物来源:尿苷(uridine)。尿苷为生化过程和可能的治疗途径提供了深入的研究。当癌细胞无法获得葡萄糖时,它们能够适应。科学家们之前已确定了作为胰腺癌燃料来源的其他营养物;这项新的研究将尿苷加入了这个营养物清单中。
胰腺肿瘤几乎没有正常发挥功能的血管,不能轻易获得来自血液的营养物,如葡萄糖。研究者Costas Lyssiotis博士解释说,如果没有合适的营养物,胰腺癌细胞就会饥饿。他说,“我们知道它们仍然在生长,显然,但它们用什么来生长呢?这些发现表明,在某些情况下,尿苷是这些燃料之一。”当被问及这一发现的影响时,论文共同第一作者Zeribe Nwosu博士说,“癌症切换到替代营养物的能力已经让我着迷了很久。阻断这类代偿性开关可能使我们获得新的治疗方法,这就是我们希望这项研究能够打开的大门。”
尿苷存在于肿瘤微环境中,但它的确切来源,以及癌细胞如何获得它,仍然是一个谜。Lyssiotis说,“部分原因是它在血液中,但我们不知道它具体来自哪里。很可能,它来自多个地方,到目前为止,我们还不能把它锁定在一个单一的来源上。”
【8】Nature:重大进展!在动物肠道中发现一种储存磷酸盐的细胞器
doi:10.1038/s41586-023-06039-y
近日,一篇发表在国际杂志Nature上题为“A phosphate-sensing organelle regulates phosphate and tissue homeostasis”的研究报告中,来自美国哈佛医学院布拉瓦特尼克研究所的研究人员在研究果蝇肠道中的磷酸盐运输时发现了一些非凡的东西--一种从未见过的细胞器。
细胞器是在细胞内执行特定功能的结构,是大多数生物学入门课程的基础。主要的细胞器包括保存着DNA并将DNA转录为RNA的细胞核;将RNA翻译为蛋白的内质网;对蛋白进行酶处理的高尔基体;以及为细胞提供能量、参与监测和调节细胞以及一些细胞间交流的线粒体。动物细胞内还存在其他几十种次要的细胞器,人们可能认为经过这么多年的研究,每种细胞器都被发现了。事实并非如此。
在这项新的研究中,这些作者忙于一项实验,它证实无机磷酸盐缺乏诱导果蝇中肠消化上皮中的过度增殖和肠细胞(enterocyte)分化。他们推测,由于无机磷酸盐是细胞生命所必需的,这可能是一种产生更多能够吸收磷酸盐的肠细胞的生存机制。他们还观察到,在磷酸盐耗尽的状态下,基因PXo(CG10483)的表达也较低。由于对PXo蛋白的作用感兴趣,他们设计了一些实验。通过抑制PXo的表达或完全剔除该基因,他们观察到与诱导无机磷酸盐缺乏时相同的效果,这表明PXo在磷酸盐运输中起着关键作用。如果这项研究到此为止,人们对磷酸盐代谢和细胞信号传导的知识将有一个很好的补充,但实际上它并没有到此为止。
【9】Nature:新研究有望开发出不会导致成瘾和幻觉的止痛药
doi:10.1038/s41586-023-06030-7
治疗疼痛而不引发危险副作用(如欣快感和成瘾)的策略已被证明是比较困难的。几十年来,科学家们一直试图开发出能够选择性地激活一种类型阿片受体(opioid receptor)来治疗疼痛,同时不激活与成瘾有关的另一种类型阿片受体的药物。不幸的是,这些化合物可能会引起另一种不想要的效果:幻觉。近日,一篇发表在国际杂志Nature上题为“Ligand and G-protein selectivity in the κ-opioid receptor”的研究报告中,来自美国华盛顿大学圣路易斯医学院等机构的研究人员发现了一条潜在的止痛途径,它既不会引发成瘾,也不会激活导致幻觉的途径。
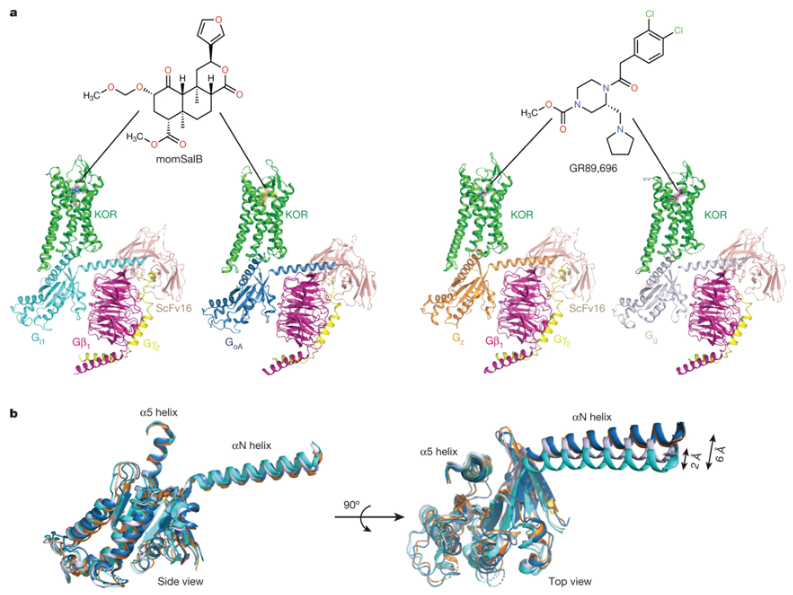
与Gi/o家族亚型结合在一起的κ型阿片受体的低温电镜结构
图片来源:Nature, 2023, doi:10.1038/s41586-023-06030-7。
吗啡和羟考酮等止痛药,以及海洛因和芬太尼等非法街头毒品,都会激活神经细胞表面上所谓的μ型阿片受体(mu opioid receptor)。靶向这种受体可以缓解疼痛,但也会引起欣快感(euphoria),即兴奋的会导致成瘾的感觉。另一种策略是靶向另一种称为κ型阿片受体(kappa opioid receptor)的阿片受体。试图制造仅靶向κ型阿片受体的药物的科学家们发现,它们也能有效地缓解疼痛,但它们可能与其他副作用有关,如幻觉。
这些作者确定了这种幻觉背后的潜在机制,目的是开发没有这种副作用的止痛药。利用电子显微镜,他们确定了一种与鼠尾草植物有关的天然化合物仅选择性地结合κ型阿片受体随后导致幻觉的方式。研究者Tao Che博士说,“自2002年以来,科学家们一直试图了解这种小分子如何通过κ型阿片受体引起幻觉。我们确定了它如何与这种受体结合并激活潜在的致幻途径,但我们也发现κ型阿片受体上的其他结合点并不导致幻觉。”开发靶向κ型阿片受体上的这些其他结合位点的新药物可能会缓解疼痛,不会出现与较老的阿片类药物有关的成瘾问题,也不会出现与选择性地靶向κ型阿片受体的现有药物有关的幻觉。
【10】告别染发剂?Nature重磅:科学家发现白发可逆变黑的“开关”!
doi:10.1038/s41586-023-05960-6
随着生活压力的增大,“白发”已不仅仅是中老年人的标配,越来越多的青壮年年纪不大却已“早生华发”,武侠小说和影视剧中也常常有“一夜白头”的桥段。长白头发不仅显老,还影响精神样貌,十分让人头疼。目前,对抗白发最常见的方式就是染发了,从理发馆出来的那一刻,便好似从“头”开始,焕然一新了。那么,显美显帅显年轻的“染发”长期使用是安全的么?
早在2020年,BMJ杂志就曾发表了一篇随访36年,11万余名女性参与的前瞻性研究,探究了个人使用永久性染发剂与癌症风险及死亡率之间的关系。结果发现,个人使用永久性染发剂与大多数癌症风险和癌症相关死亡率之间未发现正相关关系,但基底细胞癌、乳腺癌和卵巢癌的风险增加。果然,染发有风险,爱美须谨慎!不过,科学家对于头发的研究也从未停止。近日,顶级期刊Nature发表一篇题为“Dedifferentiation maintains melanocyte stem cells in a dynamic niche”的研究论文,从负责头发色素沉着的黑色素细胞干细胞(McSC)系统中发现了头发变白的原因。或许在不久的未来,发掘一种预防头发变白、甚至逆转白发变黑的健康新方法将不再是梦想!
来自美国纽约大学格罗斯曼医学院Mayumi Ito教授团队通过3D成像、遗传标记和scRNA-seq等技术,对小鼠黑色素细胞干细胞(McSC)的自我更新能力、分化轨迹、去分化、可逆性调节等一系列过程进行了深入分析研究。首先,我们先来了解一下黑色素细胞干细胞(McSC)系统。负责头发色素沉着的黑色素细胞干细胞(McSC)系统组织与毛囊干细胞(HFSC)组织相似。McSCs位于休止期毛囊(HFs)的隆突(bulge)区和毛基质(hair germ ,HG)区域,McSCs被毛囊上皮干细胞(隆突细胞)和祖细胞(HG细胞)包围,构成McSC生态位。为了验证HG McSCs是否具有自我更新能力,研究者使用小鼠模型通过体内成像技术对休止期HG McSCs进行了命运图谱。结果表明,与HFSC系统中HG上皮细胞在增殖分化后消失不同,HG中的黑色素细胞干细胞(McSC)具有自我更新能力。提示McSCs在促分化环境中聚集时依然保持其干性,大多数McSCs在转运扩增(TA)和干细胞状态之间切换,以进行自我更新和成熟后代的产生,这种机制与其他自我更新系统在根本上有所不同。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


