Science:颠覆认知!有丝分裂新模式——细胞“不变形”也能造就多样性
来源:生物探索 2025-05-08 17:07
这项研究为我们理解细胞分裂和组织构建提供了一个全新的视角:细胞的“身形”,特别是它在间期的形态特征,是一个此前被低估却至关重要的“指挥中心”。
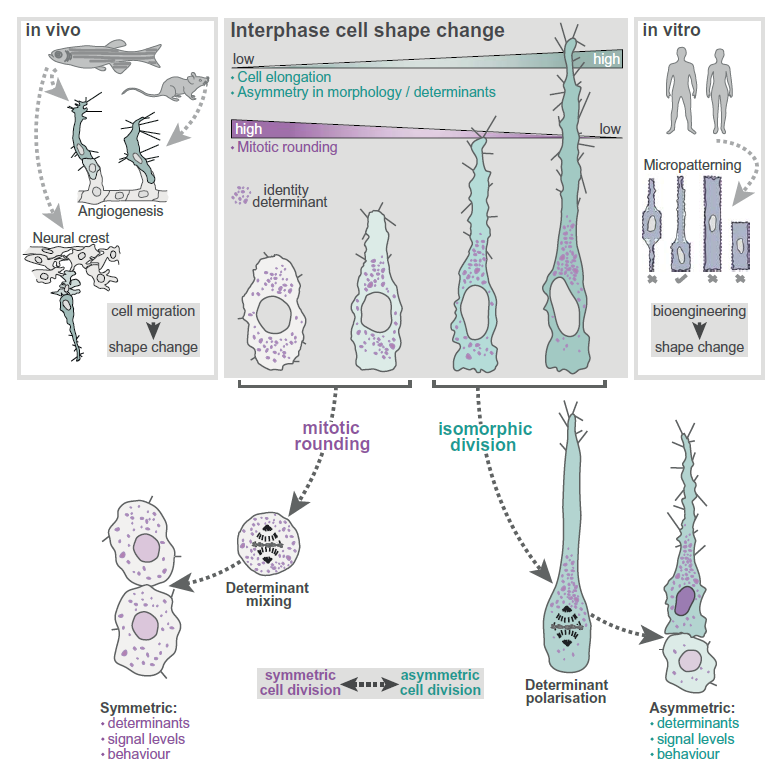
构成我们身体的亿万细胞,是如何精密协作,从一个受精卵搭建起如此复杂多样的组织结构的?细胞分裂——这个看似简单的“一分为二”过程,远比你想象的要精彩。教科书告诉我们,当细胞准备分裂时,通常会先把自己“变圆”(mitotic rounding),然后精确地分离遗传物质,产生两个大小、功能都差不多的“双胞胎”子细胞,这叫做对称分裂(symmetric division)。这种模式对于组织单纯的生长和增殖至关重要。
然而,构建像血管、神经系统这样精细、功能各异的结构时,仅仅依靠对称分裂是不够的。细胞必须能够产生不同类型的子细胞,比如血管前缘的“领头细胞”和跟随的“管壁细胞”,或者不同功能的神经元。这就需要不对称分裂(asymmetric division)登场,让母细胞分裂出“有区别”的子细胞。研究人员一直在追问,细胞是如何精准控制何时进行对称分裂、何时进行不对称分裂的?尤其是在组织发育过程中,细胞形态发生剧烈变化的同时,往往伴随着分裂模式的切换,这其中是否存在某种隐藏的联系或“指令”?
传统的观点认为,有丝分裂期的“变圆”是确保染色体顺利分离和产生对称子细胞的关键。但5月1日在《Science》上发表的重磅研究“Interphase cell morphology defines the mode, symmetry, and outcome of mitosis”,却颠覆了我们的认知!它揭示了一个令人意想不到的真相:细胞在进行有丝分裂 之前 的“身形”,也就是它在间期(interphase)时的形态,竟然能作为一种保守的“隐形指令”,深刻地影响着其后续的有丝分裂模式、子细胞的大小对称性,甚至直接预编程了子细胞未来的命运!
这项研究发现了一种全新的分裂模式——“同形分裂”(isomorphic division),在这种模式下,细胞规避了传统的“变圆”,而是保持着间期的形态特征完成分裂。那么,细胞在间期到底通过怎样的“身形”来发出这些关键指令?同形分裂又是如何打破常规,实现命运决定因子的不对称分配的?背后的分子机制究竟是什么?

有丝分裂的“标准模式”:变圆,然后对称
在深入探讨新的分裂模式之前,让我们先回顾一下经典的体细胞有丝分裂过程。对于大多数动物细胞,尤其是在二维(2D)培养环境中生长的细胞,进入有丝分裂期(mitotic entry)后,细胞会经历一个全局性的细胞骨架(cytoskeleton)重组,细胞收缩,变得近乎球形。这种有丝分裂期变圆被认为是保障分裂高保真度(high-fidelity segregation)的关键步骤。球形的细胞更容易在中央构建起纺锤体(spindle),确保染色体(chromosome)准确分离,并且能够产生大小相等的子细胞。同时,细胞内的非遗传物质,比如细胞器(organelles),通常会在分裂期被打散或均匀分布,从而在子细胞间实现对称分配(symmetric partitioning)。
这项研究中的数据显示,在二维(2D)培养皿中培养的人类内皮细胞(ECs)完美地展现了这种“标准模式”。这些ECs在进入有丝分裂中期的宽高比(Aspect Ratio, AR)显著降低,趋近于1,这意味着它们变得非常接近圆形。随后,它们分裂产生的两个子细胞在大小上也是对称的,子细胞大小比率(daughter cell size ratio)约为1:1。这再次证实了经典的观点:充分的有丝分裂期变圆通常伴随着对称分裂。
活体观察的“新发现”:细胞可以“不变形”分裂?
然而,当研究人员将视野转向活体动物组织时,他们有了惊人的发现。在斑马鱼(zebrafish)胚胎的血管形成过程中,他们观察到了血管内皮细胞(ECs)的一种特殊分裂模式。这些血管内皮细胞在血管分支生长时,会从相对静态的铺路石状形态(cobblestone-like form)转变为高度迁移、延展的形态,充当血管生长前缘的“领头细胞”(tip ECs)。令人惊讶的是,这些“领头细胞”在进入有丝分裂时,并 没有 经历显著的收缩和球形化过程!
通过详细的单细胞形态计量分析(single-cell morphometric analysis),研究人员发现,这些斑马鱼的“领头tECs”在有丝分裂中期,其细胞宽高比(Metaphase AR)与它们在间期高度延展时的宽高比(Interphase AR)非常接近。例如,间期AR可以高达6,而它们在有丝分裂中期的AR也依然维持在6左右,几乎没有变圆。研究人员将这种有丝分裂期间细胞形态特征与间期相似,不发生显著变圆的分裂模式,命名为“同形分裂”(isomorphic division)。这种模式与经典的球形分裂(细胞中期AR显著低于间期AR)形成了鲜明对比。
同形分裂并非仅在斑马鱼血管内皮细胞中存在。研究人员在小鼠(mouse)视网膜(retinal)血管内皮细胞以及斑马鱼的神经嵴细胞(neural crest cells, tNC)和侧线神经元基板细胞(PLLp cells)等多种在体内迁移、呈间充质样形态的细胞中,都观察到了同形分裂。这表明,同形分裂是一种在不同组织和细胞类型中保守存在的有丝分裂模式。
模式图(Credit: Science)
谁在幕后指挥?间期“身形”说了算!
既然发现了同形分裂这种新的模式,下一个关键问题就是:是什么决定了细胞会选择经典的球形分裂还是同形分裂?研究人员注意到,发生同形分裂的细胞在间期普遍呈现出高度延展、具有前后极性(front-rear polarity)的特征,比如斑马鱼tECs在迁移时会显著伸出前端突起。他们推测,细胞在有丝分裂 之前 的间期形态,可能就是决定分裂模式的关键“指令”。
通过对斑马鱼tECs的分析,研究人员发现,细胞的间期形态与有丝分裂期间的收缩程度存在紧密关联。细胞间期延展性越高(间期前部宽高比fAR越高),其细胞前端在有丝分裂期间的收缩(retraction)越少,越倾向于同形分裂。数据显示,在体内的斑马鱼tECs中,那些间期fAR高的细胞,其细胞前端的收缩率(percentage retraction of the cell front)接近0%,它们进行的是同形分裂;而间期fAR低的细胞,其前端收缩率可以高达80%以上,进行的是经典的球形分裂。
为了进一步证实这种关联的因果性,研究人员利用微模式(micropatterning)技术在体外对人类内皮细胞的形态进行精确调控。他们在基底上印刻了不同形状的纤维连接蛋白(fibronectin)图案,诱导细胞在间期呈现不同的形状:有模拟体内延展细胞的“臂状”(arm pattern)和模拟对称细胞的“盒状”(box pattern)。在不干扰有丝分裂收缩的情况下,这些细胞无论在何种图案上,都会在有丝分裂期充分变圆,进行经典的对称分裂。然而,当研究人员使用ROCK抑制剂(ROCKi)或Blebbistatin抑制细胞的有丝分裂期皮层收缩,从而“强制”它们部分或完全不发生有丝分裂期变圆时,细胞在间期的形态就显现出决定性作用。在“臂状”图案上,间期呈延展、极性形态的细胞在ROCKi处理后进行同形分裂,并产生了大小不对称的子细胞(子细胞大小比率 > 1:1)。而在“盒状”图案上,间期呈对称形态的细胞在ROCKi处理后,虽然也不充分变圆,但依然产生了大小近乎对称的子细胞(子细胞大小比率接近1:1)。这有力地证明,细胞在间期的几何形态可以精确地调控同形分裂中的分裂对称性。
除了细胞的整体形状,研究还发现细胞核的位置(nuclei positioning)也是一个重要的间期形态指令。在用ROCKi处理、进行同形分裂的神经嵴祖细胞(NPCs)中,研究人员发现,细胞核在进入前期(prophase)时的位置决定了后续的分裂对称性。如果细胞核在前期偏向一侧(polar position),则分裂会产生大小不对称的子细胞;如果细胞核位于中心(equatorial position),则会产生对称子细胞。进一步分析显示,细胞核在前期时的偏离程度(nuclei offset)与子细胞大小的不对称性之间存在显著的相关性。而在体内的斑马鱼tECs中,细胞核在间期通常偏向血管基底一侧(proximal position),这种偏向性也准确预测了有丝分裂中期板(metaphase plate)和分裂沟(cleavage furrow)的位置,并最终导致了不对称分裂。这些发现共同揭示了一个核心原理:细胞在有丝分裂 之前 展现出的特定“身形”(延展的细胞形态和偏向的细胞核位置),是决定其采取同形分裂模式并产生不对称子细胞的关键间期指令。
命运的“不对称分配”:同形分裂打破平衡
那么,同形分裂产生大小不对称的子细胞,这仅仅是形态上的差异吗?研究人员发现,这种不对称性具有深刻的生物学意义——它能够实现细胞内关键命运决定因子(fate determinants)的不对称分配,从而赋予子细胞不同的身份和功能,这正是组织构建所需细胞多样性的基础。
以血管内皮细胞的命运决定因子为例,血管内皮生长因子受体2(VEGFR2)的信号水平差异决定了tECs是成为继续迁移的“领头细胞”还是分化为跟随的“管壁细胞”。研究发现,在间期呈延展形态的细胞中,VEGFR2在细胞内的分布本身就呈现出前后极性。然而,在经典的球形有丝分裂中,这种间期的极性分布会被打乱,细胞质成分充分混合,导致VEGFR2在子细胞间对称分配。但令人兴奋的是,在同形分裂中,细胞由于没有充分变圆,其间期的VEGFR2前后极性分布得以 保留,并最终导致VEGFR2在两个子细胞之间发生显著的 不对称分配(子细胞VEGFR2荧光强度比率 > 1:1)。这种VEGFR2的不对称继承直接导致了下游信号分子pERK(磷酸化细胞外信号调节激酶)水平的差异(子细胞pERK比率 > 1:1),从而预编程了子细胞是成为高信号水平的“领头”子细胞还是低信号水平的“管壁”子细胞。
研究人员还将这一原理扩展到其他细胞类型和命运决定因子。例如,在神经嵴祖细胞中,用于决定神经元命运的Notch配体DLL1(Notch ligand DLL1)虽然在间期没有表现出前后极性,但在ROCKi诱导的同形分裂中,如果子细胞大小不对称,DLL1也表现出不对称分配。这进一步支持了通过同形分裂,细胞可以将间期形态信息耦合到命运决定因子的不对称分配上,从而产生细胞多样性。这意味着,细胞在间期的特定“身形”,可以作为一个“预编程”的信号,通过同形分裂实现关键分子的不对称传递,最终指导子细胞走向不同的命运。
解密“指挥链”:肌动球蛋白与Rab4内吞体的协作
细胞如何感知并执行这些“间期身形”指令?同形分裂又是如何得以维持间期极性并实现不对称分配的?研究人员深入探索了其分子机制。
首先,间期细胞的形状如何影响有丝分裂期的收缩(变圆)?研究发现,这与细胞内的肌动球蛋白(actomyosin)活动密切相关。皮层肌动球蛋白的收缩是导致细胞在有丝分裂期变圆的主要驱动力。数据表明,高度延展(高AR)的tECs在有丝分裂期间,其延长突起处的皮层F-actin(肌动蛋白丝)积累水平较低,这意味着皮层肌动球蛋白组装不足,因此它们难以有效收缩和变圆,倾向于同形分裂(平均细胞前端回收率接近0%)。相比之下,延展性较低(低AR)的tECs在有丝分裂期能够有效地在细胞体最宽处聚集皮层F-actin,从而实现充分收缩(前端回收率高达80%以上)。通过遗传或药物手段(如CalA)扰动肌动球蛋白活性,可以影响有丝分裂期收缩程度,甚至强制那些原本会同形分裂产生不对称子细胞(子细胞大小比率>1:1)的延展性细胞,转变为经历更多收缩、产生近乎对称子细胞(子细胞大小比率接近1:1)的模式,并扰乱pErk的不对称性(子细胞pErk比率趋近1:1)。这证实了有丝分裂期收缩程度是调控同形分裂对称性的关键,而间期形态则通过影响皮层肌动球蛋白活动来调节收缩程度。
其次,同形分裂如何实现命运决定因子的不对称分配?这涉及到细胞内的内吞体系统(endosomal compartments)。研究发现,VEGFR2在细胞内分布在不同类型的内吞体中,包括Rab5阳性的分选内吞体(Rab5-positive sorting endosomes)和Rab4阳性的循环内吞体(Rab4-positive recycling endosomes)。Rab5内吞体通常与有丝分裂纺锤体有相互作用,在经典的球形分裂中会充分混合并对称分配。令人意想不到的是,虽然在间期呈延展形态的细胞中,Rab5内吞体也表现出显著的前后极性分布,但在同形分裂中,它们依然能被有效地混合并对称分配(子细胞Rab5比率接近1:1)。然而,Rab4阳性循环内吞体则表现出不同的行为。它们在间期的极性分布不如Rab5显著,但在同形分裂中,Rab4内吞体 没有 被充分混合,其间期的偏向分布得以保持,最终导致了Rab4内吞体在子细胞间的不对称分配(子细胞Rab4比率 > 1:1)。这种Rab4的不对称分配与子细胞大小的不对称性密切相关(它们之间存在显著的正相关性)。
更关键的是,研究人员通过沉默Rab4(使用siRNA降低Rab4的表达水平)实验,证实了Rab4在连接间期形态和VEGFR2不对称分配中的关键作用。在缺乏Rab4的情况下,即使细胞进行同形分裂并产生大小不对称的子细胞,VEGFR2的不对称分配也受到显著影响(子细胞VEGFR2比率趋近1:1),其不对称性大幅降低。这表明,Rab4阳性的循环内吞体就像是细胞内的一个“记录仪”,它们能够感知并“记住”细胞在间期的特定形态特征(尤其是极性信息),并在同形分裂过程中将这些信息传递下去,确保与命运决定因子(如VEGFR2)的非随机、不对称分配。
重塑细胞分裂的理解
这项研究的发现,对我们传统上对体细胞有丝分裂的理解提出了重要的挑战和补充。过去,有丝分裂期的“变圆”被视为一个几乎普适且至关重要的过程。而这项研究表明,至少在构建复杂组织的间充质样细胞中,存在一种重要的替代模式——同形分裂,它规避了显著的变圆。
更重要的是,这项工作揭示了细胞在间期的形态变化,不仅仅是为后续的组织运动或功能做准备,它本身就包含了一种“指令”,能够动态地调控有丝分裂的模式和结果。通过同形分裂,细胞能够有效地将间期形成的形态极性(如延展和核偏向)和细胞内分子(如VEGFR2及其所在的Rab4内吞体)的偏向分布,直接传递给子细胞,从而实现命运决定因子的不对称分配,驱动子细胞获得不同的身份和行为。相比于需要在球形化的有丝分裂期从头建立不对称性的复杂机制,同形分裂提供了一种更直接、更简单的途径来继承间期极性信息。
这项研究还具有重要的普适性。研究人员发现,通过微模式技术,可以在体外强制任何测试过的间充质样细胞产生可预测的不对称分裂结果,这进一步印证了间期形态指令的保守性和强大作用。
未来,这项研究也提出了一系列引人入胜的新问题。同形分裂中的细胞是如何在不完全变圆的情况下,仍然保持有丝分裂高保真度,成功完成染色体分离并避开相关的检查点(checkpoints)的?细胞在间期与微环境的粘附(cell adhesion)状态,在这种分裂模式的调控中扮演了怎样的具体角色?同形分裂和间期形态指令在癌症等与细胞过度增殖和异常行为相关的疾病中,又是否发挥着作用?
总而言之,这项研究为我们理解细胞分裂和组织构建提供了一个全新的视角:细胞的“身形”,特别是它在间期的形态特征,是一个此前被低估却至关重要的“指挥中心”,它动态地调控着细胞分裂的整个过程,并将形态变化与子细胞命运的确定功能性地耦合起来,最终指导着复杂组织的有序构建。这不仅是对细胞生物学基础理论的重大突破,也为探索组织修复和疾病机制提供了新的思路。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


