Nature:肠道干细胞的“能量密码”,揭秘α-酮戊二酸如何决定细胞命运
来源:生物谷原创 2025-06-24 11:49
来自纪念斯隆-凯特琳癌症中心等机构的科学家们通过研究揭示了α-酮戊二酸或能通过调控肠道干细胞的命运从而影响肠道的再生和修复。
在生物医学研究领域,细胞代谢与干细胞命运的联系正逐渐成为前沿热点。过去,我们常常认为细胞的命运是由基因和信号通路决定的,而代谢过程只是为细胞活动提供能量。然而,越来越多的研究表明,代谢产物本身也可能直接调控细胞的命运。
近日,一篇发表在国际杂志Nature上题为“Metabolic adaptations direct cell fate during tissue regeneration”的研究报告中,来自纪念斯隆-凯特琳癌症中心等机构的科学家们通过研究揭示了α-酮戊二酸或能通过调控肠道干细胞的命运从而影响肠道的再生和修复。
研究者表示,作为一种关键的代谢产物,α-酮戊二酸(α-KG)能决定肠道干细胞分化为吸收性细胞还是分泌性细胞,这一发现不仅改变了科学家们对细胞代谢的传统认识,还为治疗肠道疾病提供了新的思路。研究者指出,作为细胞的能量工厂,线粒体负责通过分解蛋白质、脂肪和碳水化合物来生成携带能量的ATP分子,然而,随着研究的深入,科学家们逐渐意识到,线粒体在细胞功能和命运调控中扮演着更为复杂的角色;特别是,线粒体中的代谢产物,如α-酮戊二酸(α-KG),在细胞分化过程中可能具有重要的信号传导功能。这项研究正是基于这一背景探索了α-KG如何影响肠道干细胞的命运。
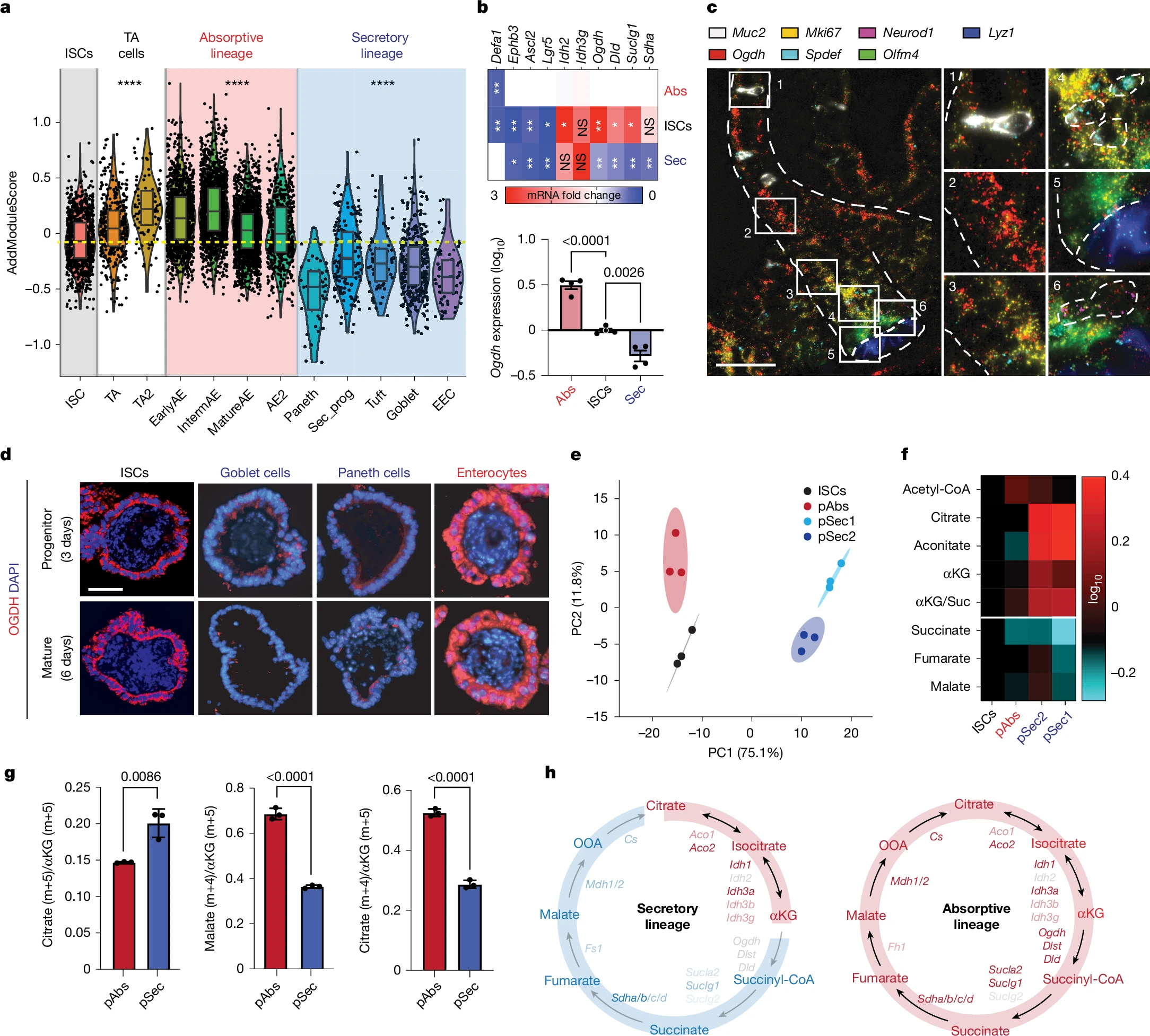
肠道谱系的代谢分化
研究人员首先观察了人类和小鼠肠道细胞中三羧酸循环(TCA cycle)酶的表达差异,他们发现,吸收性细胞中2-氧代戊二酸脱氢酶(OGDH)的表达水平较高,而分泌性细胞中该酶的表达较低。OGDH负责将α-KG转化为琥珀酰辅酶A(succinyl-CoA)。通过遗传和药理学方法,研究者们进一步证实了OGDH的差异表达如何通过代谢途径影响肠道干细胞的命运。
研究结果表明,在吸收性细胞中,高表达的OGDH能支持细胞的能量和生物合成需求;而在分泌性细胞中,由于OGDH表达较低,α-KG会积累从而激活TET酶的功能,还会促进分泌性细胞的分化,这一过程涉及到了DNA去甲基化,其能将5-甲基胞嘧啶(5mC)转化为5-羟甲基胞嘧啶(5hmC)从而促进分泌性细胞相关基因的表达。
特别值得注意的是,在患有结肠炎的小鼠模型中,分泌性细胞的成熟会受到损害。然而通过抑制OGDH或补充α-KG,研究者们就能成功恢复分泌性细胞的功能并促进组织修复,这一发现不仅能揭示代谢产物在细胞命运决定中的作用,还为治疗炎症性肠病等疾病提供了潜在的治疗策略。
本文研究不仅揭示了α-酮戊二酸在肠道干细胞分化中的关键作用,还展示了代谢干预在治疗肠道疾病中的潜力,通过调节细胞内的代谢产物水平,研究人员或能开发出新方法促进受损组织的再生和修复,这一发现不仅为理解细胞代谢和干细胞生物学提供了新的视角,也为未来的临床应用带来了希望。(生物谷Bioon.com)
参考文献:
Chaves-Perez, A., Millman, S.E., Janaki-Raman, S. et al. Metabolic adaptations direct cell fate during tissue regeneration. Nature (2025). doi:10.1038/s41586-025-09097-6
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


