科学家们如何利用纳米颗粒来治疗多种人类疾病?
来源:本站原创 2021-08-27 17:14
近年来,科学家通过深入研究成功实现了利用纳米颗粒来治疗多种人类疾病,那么近期科学家们在该研究领域又取得了哪些成果呢?小编对相关研究成果进行了整理,分享给大家!
近年来,科学家通过深入研究成功实现了利用纳米颗粒来治疗多种人类疾病,那么近期科学家们在该研究领域又取得了哪些成果呢?小编对相关研究成果进行了整理,分享给大家!
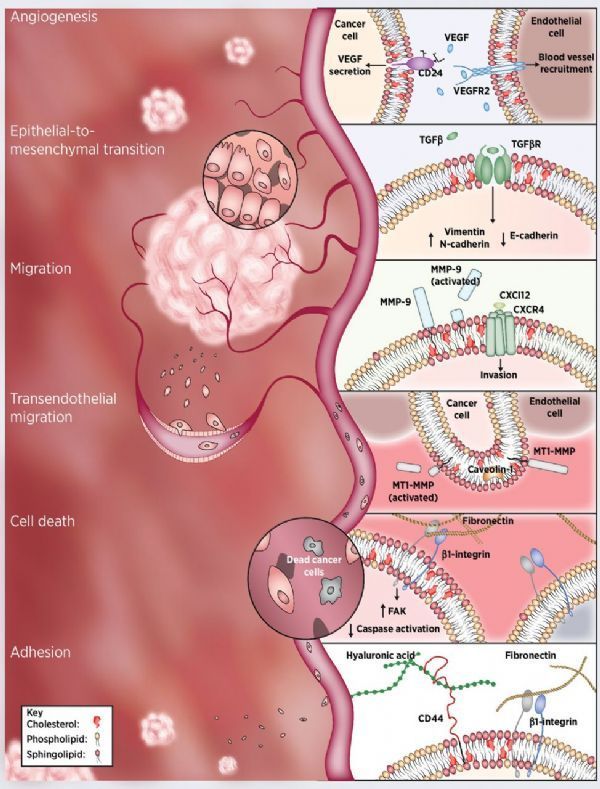
脂筏结构在癌细胞转移和细胞死亡上扮演着重要角色。
图片来源:Joshua D. Greenlee, et al. Cancer Research (2020). DOI:10.1158/0008-5472.CAN-20-2199
【1】Cancer Res:特殊蛋白包被的纳米颗粒或有望杀灭恶性结肠癌细胞
doi:10.1158/0008-5472.CAN-20-2199
脂筏(Lipid rafts)是质膜内紧密包装、富含胆固醇和鞘磷脂的微结构域,其在许多病理生理学过程中扮演着重要角色;此前研究人员认为脂筏结构是癌症信号转导的主要调节器,其中脂筏的区室化会促进跨膜受体的寡聚化,并能保护蛋白免于酶类的降解,同时还能作为支架来增强细胞内的信号级联转导;如今研究人员发现癌细胞能利用这些机制来开启致癌信号转导并促进肿瘤的进展。
近日,一篇发表在国际杂志Cancer Research上题为“Rafting Down the Metastatic Cascade: The Role of Lipid Rafts in Cancer Metastasis, Cell Death, and Clinical Outcomes”的研究报告中,来自范德堡大学等机构的科学家们通过研究找到了癌细胞在最初化疗过程中幸存下来的“致命弱点”,他们调查了免疫细胞中一种名为TRAIL的天然产生蛋白质是否能有效杀灭结肠癌细胞。相关研究结果或有望帮助开发新型疗法,从而使得侵袭性的癌细胞在扩散到机体其它部位之前能更容易地被杀死。
研究者发现,TRAIL能有效杀灭这些耐药性的结肠癌细胞,这些细胞表面上携带有大量名为死亡受体4的特殊蛋白,顾名思义,当这些受体与TRAIL结合后就会导致细胞死亡;此外,这些死亡受体还更易于聚集在细胞膜上,即所谓的脂筏结构,当研究者在脂筏中发现这些受体时,TRAIL就能够更加有效地杀死癌细胞。利用这一知识,研究者King等人设计出了覆盖TRAIL涂层的纳米颗粒,其能杀灭对化疗耐药的晚期结肠癌患者血液中57%的癌细胞;在一些病人的血液样本中,这种纳米颗粒甚至能破坏所有检测到的癌细胞,这些患者体内高水平的脂筏死亡受体4或与TRAIL覆盖的纳米颗粒疗法有效性的增加相吻合。
【2】Science子刊:利用脂质体纳米颗粒递送靶向IL1RAP基因的CRISPR/Cas9,可让白血病干细胞无处可逃
doi:10.1126/sciadv.abg3217
急性骨髓性白血病(AML)是一种侵袭性的血癌,只有28%的AML患者能够存活5年。作为一种异质性血液恶性肿瘤,AML以异常增殖和分化受损为特征,是成人急性白血病的主要类型,在美国所有白血病亚型中死亡人数最多。在一项新的研究中,来自美国和韩国的研究人员开发出一种攻击白血病的最新方法,该方法有点像消灭蟑螂。它是一个三步骤过程:使用尖端技术诱导、诱捕和杀死白血病细胞的根源:白血病干细胞(leukemia stem cell, LSC),又称为白血病起始细胞(leukemia-initiating cell, LIC)。这一发现对于治疗AML患者具有重要的临床意义。相关研究结果近期发表在Sciences Advances期刊上,论文标题为“Scaffold-mediated CRISPR-Cas9 delivery system for acute myeloid leukemia therapy”。
论文第一作者、美国罗彻斯特大学医学中心威尔莫特癌症研究所血液学/肿瘤学研究助理教授Tzu-Chieh (Kate) Ho博士说,尽管这项研究还处于早期阶段,只在小鼠和人类细胞培养物中进行了测试,但它与化疗等标准方法有很大不同,因为它使科学家能够校正那些助长癌症的错误基因。
这些作者开发的这种新方法使用可以编辑细胞内基因的CRISPR/Cas9技术。具体而言,他们使用一种生物还原性脂质体封装的Cas9/单向导RNA(sgRNA)核糖核蛋白[脂质体纳米颗粒(LNP)-Cas9 RNP]来靶向人类LSC中的关键基因:白细胞介素-1受体辅助蛋白(IL1RAP)。为了增强对LSC的靶向性,他们将LNP-Cas9 RNP和趋化因子CXCL12α装载到模拟骨髓微环境的涂有间充质干细胞膜的纳米纤丝(mesenchymal stem cell membrane–coated nanofibril, MSCM-NF)支架上。
在体外,CXCL12α释放诱导LSC迁移到MSCM-NF支架上,LNP-Cas9 RNP就高效地对LSC中的IL1RAP基因进行编辑,从而实现IL1RAP基因敲除。IL1RAP基因敲除会降低LSC集落生成能力和白血病负荷。基于MSCM-NF支架的递送可增加LNP-Cas9在骨髓腔中的停留时间。总之,通过装载CXCL12α的LNP/MSCM-NF支架局部持续递送Cas9/IL1RAP sgRNA提供了一种高效减少LSC生长的策略,从而改善AML疗法。
【3】Science:重大进展!嵌合纳米颗粒可针对一系列冠状病毒产生交叉免疫反应,有望开发出通用冠状病毒疫苗
doi:10.1126/science.abf6840
引起大流行的SARS-CoV-2病毒只是冠状病毒家族中许多不同病毒中的一种。这种病毒家族中的许多成员在蝙蝠等动物种群中传播,并有可能像SARS-CoV-2一样,“跳到” 人类群体中。美国加州理工学院生物学与生物工程教授Pamela Bj?rkman及其团队正在致力于开发针对一系列相关冠状病毒的疫苗,目的是预防未来的大流行病。
如今,研究人员设计了一种基于蛋白的60亚单位纳米颗粒,该纳米颗粒上面附着了多达8种不同类型的冠状病毒的片段。当注射到小鼠体内时,这种疫苗会诱导产生对各种不同的冠状病毒---包括没有呈现在这种纳米颗粒上的类似病毒---作出反应的抗体。相关研究结果于2021年1月12日在线发表在Science期刊上,论文标题为“Mosaic nanoparticles elicit cross-reactive immune responses to zoonotic coronaviruses in mice”。
这种称为嵌合纳米颗粒(mosaic nanoparticle)的疫苗平台,最初是由英国牛津大学的合作者开发的。这种纳米颗粒的形状就像是由60个相同蛋白组成的笼子,每蛋白上都有一个小的功能类似于尼龙搭扣(Velcro)的蛋白标签。Cohen 和他的团队获取不同冠状病毒的刺突蛋白(刺突蛋白在感染中起着最大的作用)的片段,并给每个片段添加可与纳米颗粒笼子上的蛋白标签结合在一起的蛋白标签。当这些病毒片段与纳米颗粒笼子结构混合在一起时,每个病毒片段上的标签都会附着在笼子上的蛋白标签上,从而使得纳米颗粒表面上呈现出代表不同冠状病毒毒株的刺突蛋白片段。
图片来源:Pixabay/CC0 Public Domain。
【4】Science子刊:开发出可穿过血脑屏障将药物递送到大脑的纳米颗粒,有望治疗一系列神经退行性疾病
doi:10.1126/sciadv.abd6889
在过去的几十年里,科学家们已经确定了导致神经退行性疾病的生物途径,并开发了针对这些途径的有前途的分子制剂。然而,将这些发现转化为临床批准的治疗方法的进展速度要慢得多,部分原因是人们在将治疗药物穿过血脑屏障(blood-brain barrier, BBB)并送入大脑方面所面临的挑战。为了促进治疗药物成功地递送到大脑,来自美国布莱根妇女医院和波士顿儿童医院的研究人员在一项新的研究中,构建出一种纳米颗粒平台,它在小鼠中可以促进将封装的药物有效地递送到物理上被破坏或完整的BBB中。在创伤性脑损伤(TBI)的小鼠模型中,他们观察到这种递送系统在大脑中的累积量是传统递送方法的三倍,而且治疗效果也很好,这可能为治疗众多神经系统疾病提供了可能性。相关研究结果发表在Science Advances期刊上,论文标题为“BBB pathophysiology–independent delivery of siRNAin traumatic brain injury”。
以前开发的将治疗药物递送到TBI发生后的大脑中的方法依赖于头部物理损伤后的短暂时间窗口,此时BBB暂时被破坏。然而,在被破坏的BBB在几周内受到修复后,医生缺乏有效的药物递送工具。研究者Nitin Joshi博士说,“无论大分子还是小分子治疗剂都很难穿过BBB。我们的解决方案是将治疗剂封装到具有精确工程化表面特性的生物相容性纳米颗粒中,使得它们在治疗上有效地递送到大脑中,与BBB的状态无关。”
【5】Cell:一种创新的纳米颗粒候选SARS-CoV-2疫苗可引发超强效的中和抗体反应
doi:10.1016/j.cell.2020.10.043
在一项新的研究中,来自美国华盛顿大学等研究机构的研究人员发现一种针对大流行性冠状病毒SARS-CoV-2的创新纳米颗粒候选疫苗在小鼠体内产生的病毒中和抗体的水平比从COVID-19感染中恢复的人的水平高10倍。这种候选疫苗由华盛顿大学医学院的科学家们设计,目前已转给两家公司进行临床开发。相关研究结果于2020年10月30日在线发表在Cell期刊上,论文标题为“Elicitation of potent neutralizing antibody responses by designed protein nanoparticle vaccines for SARS-CoV-2”。
与许多领先的COVID-19候选疫苗所基于的可溶性SARS-CoV-2刺突蛋白(S蛋白)相比,这种新的纳米颗粒候选疫苗在小鼠体内产生的中和抗体要高出10倍,即使疫苗剂量降低了6倍,也是如此。这些数据还显示,免疫接种后的B细胞反应强烈,这对免疫记忆和持久的疫苗效果至关重要。当给一种非人灵长类动物注射时,这种纳米颗粒疫苗产生了针对刺突蛋白上多个不同部位的中和抗体。这些研究人员表示,这可能确保在这种病毒的变异株出现时,能够保护这些动物免受病毒变异株的侵害。刺突蛋白是SARS-CoV-2感染复合物的一部分。
这种候选疫苗是利用华盛顿大学医学院发明的基于结构的疫苗设计技术开发的。它是一种自组装的蛋白纳米颗粒,在一个高度免疫原性的阵列中显示60个SARS-CoV-2刺突蛋白的受体结合结构域。这种疫苗的分子结构大致模拟这种冠状病毒的分子结构,这可能是它引发增强的免疫反应能力的原因。
【6】Nat Cell Biol: 纳米颗粒能够用于治疗耐受性淋巴癌
doi:10.1038/s41556-020-0507-y
根据最近在Nature Cell Biology杂志上发表的一篇论文,来自UConn的研究者们发现一种常用的化疗药物可能被重新用于治疗复发性或耐药性白血病。癌症治疗的最大问题之一是癌细胞会产生对抗治疗的抵抗力。15至20%的儿童和多达三分之二的成人白血病患者会出现复发情况。复发后成年患者的五年生存率不到30%。对于儿童,复发后的五年生存率约为三分之二。当复发后,化学疗法无法改善这些患者的预后,因此迫切需要开发一种可以更有效地靶向耐药细胞的疗法。
Wnt-β-catenin和PI3K-Akt是两种不同的细胞信号通路,它们在干细胞调节和肿瘤再生中起关键作用。 Wnt-β-catenin和PI3K-Akt途径的协同激活可驱动细胞自我更新,从而导致癌症复发。在最近的研究中,研究人员筛选了数百种药物,以寻找可能抑制这种相互作用的药物。他们确定了最常用的化疗药物——阿霉素。虽然该药物具有剧毒,但研究小组发现,以多次低剂量使用时,它会破坏Wnt-β-catenin和PI3K-Akt途径的相互作用,同时有可能降低毒性。
此外,作者还开发了一种纳米粒子载体,可以用于安全地注射药物并随着时间推移起到持续释放的效果。包裹阿霉素的纳米颗粒可将药物缓慢释放至骨髓,从而降低耐药性白血病干细胞中Akt激活的β-catenin的水平,并降低肿瘤细胞活性。在低剂量下,阿霉素能够刺激免疫系统。
图片来源:PNAS,doi:10.1073/pnas.2001569117
doi:10.1073/pnas.2001569117
抑制免疫系统,所以这些类型的治疗并不适用于所有的病人。麻省理工学院的工程师们现在想出了一种方法来提高一种癌症免疫疗法的效果。他们表明,如果用现有的检查点抑制剂和新的纳米颗粒来治疗小鼠,进一步刺激免疫系统,这种疗法就会比单独使用检查点抑制剂更有效。研究人员说,这种方法可以使癌症免疫疗法让更大比例的患者受益,相关研究结果发表在PNAS杂志。
"这些疗法在一小部分病人身上非常有效,而在其他病人身上则完全不起作用。目前还不能完全理解为什么会有这种差异,"该新研究的第一作者Colin Buss博士说道。麻省理工学院的研究小组设计了一种方法来包装和传递小段的DNA,增强对肿瘤的免疫反应,产生协同效应,使检查点抑制剂更有效。在对老鼠的研究中,他们发现双重治疗可以阻止肿瘤的生长,在某些情况下,还可以阻止身体其他部位肿瘤的生长。
人类的免疫系统被调节来识别和摧毁不正常的细胞,如癌细胞。然而,肿瘤分泌的许多分子在肿瘤周围的环境中抑制免疫系统,使T细胞的攻击无效。检查点抑制剂背后的想法是,它们可以消除免疫系统的"刹车",恢复T细胞攻击肿瘤的能力。其中一些针对检查点蛋白(如CTLA-4、PD-1和PD-L1)的抑制剂已被批准用于治疗各种癌症。这些药物通过关闭阻止T细胞被激活的检查点蛋白发挥作用。
doi:10.1038/s41565-020-0669-6
含遗传药物的脂质纳米粒可以通过生物工程调整其生物分布,诱导器官特异性基因调控。脂质纳米颗粒(LNP)技术使一种小干扰siRNA (siRNA)药物的临床转化和首次获得美国食品和药物管理局(FDA)的批准成为可能。该纳米药物是为治疗遗传性疾病转胸腺视蛋白介导的淀粉样变性引起的多神经病而开发的,它依赖于高效的lnp介导的siRNA在静脉滴注后传递到肝细胞,从而抑制病理蛋白的产生。LNP系统还允许信使RNA (mRNA)的包封,以诱导治疗性蛋白的产生,并允许基因编辑复合物全身给药后纠正肝细胞中的致病突变。然而,在肝脏以外的组织和器官中实现治疗相关的基因调控仍是一个未解之谜。
在最新一期Nature Nanotechnology上,研究者Qiang Cheng等人提出了一种称为选择性器官靶向(SORT)的方法,通过生物工程将含有核酸疗法的LNPs诱导肝脏、脾脏和肺特异性基因调控。LNP系统通常由磷脂、胆固醇、聚乙二醇(PEG)脂质和可电离的阳离子脂质组成。每个LNP成分及其摩尔比都已被优化,以确保高效的核酸递送到肝细胞。特别是,合理设计和筛选可电离的阳离子脂质(或类脂质)文库对于实现临床应用相关剂量的肝基因沉默至关重要。最有效的电离阳离子脂质,其特征是明显的pKa值在6.2和6.5之间,具有三种功能:(1)在LNP生产期间,酸性pH值下质子化的叔胺脂质头部促进其与带负电荷的核酸结合,(2)在生理的pH值,附近无电荷的脂质确保净中性表面电荷,以减少免疫反应和循环时间延长和(3)细胞摄取后进入酸化的内体中,正电荷脂质促进膜融合和有效的胞质递送。
【9】Nat Nanotechnol:纳米颗粒有助于清除血栓
doi:10.1038/s41565-019-0619-3
近日,密歇根州立大学和斯坦福大学的科学家发明了一种纳米颗粒,这种颗粒可以“从内到外地”吞噬掉导致心脏病的部分斑块。密西根州立大学生物医学工程副教授Bryan Smith等人创建了一个“特洛伊木马”纳米粒子,该纳米粒子可用于降解心血管中的斑块。该发现可能是动脉粥样硬化的潜在治疗方法。
该结果发表在最近的《nature nanotechnology》杂志上。一旦进入这些巨噬细胞内部,纳米颗粒就会释放一种刺激细胞吞噬碎片的药物。进而达到了清楚斑块的目的。Smith说,由于对纳米药物的选择性,未来对纳米粒子的临床试验有望降低大多数类型心脏病发作的风险,且副作用最小。
Smith的研究集中在拦截巨噬细胞中受体的信号传导,并使用纳米免疫治疗平台通过小分子传递信息。先前的研究已经作用于细胞表面,但是这种新方法在细胞内起作用,并且在刺激巨噬细胞方面有效。Smith说:“我们可以刺激巨噬细胞有选择地吃掉死亡和将近死亡的细胞,这些炎性细胞是导致动脉粥样硬化的原因。”
【10】Sci Adv:新型金纳米颗粒或有望检测癌细胞所释放的特殊信号
doi:10.1126/sciadv.aax3223
近日,一篇发表在国际杂志Science Advances上的研究报告中,来自昆士兰大学等机构的科学家们通过研究开发了一种新型血液检测手段,其能利用金纳米颗粒来检测癌症,这种新方法能识别癌细胞所释放的特殊信号,有望帮助进行癌症的早期诊断及疗法的开发。基于这种新方法,研究人员就能检测并监测患者血液中的胞外囊泡(EVs),同时研究者还能通过快速确定疗法的进展情况来帮助开发更有效且个体化的癌症策略;研究者Jing Wang表示,EVs是血液中新一代潜在的生物标志物,其是健康细胞和癌细胞不断持续释放的纳米颗粒,能实现细胞间的通讯。
EVs就好像小气泡一样,能帮助运输“货物”,比如DNA、蛋白质和其它分子等,这些“货物”能揭示细胞内的很多事件;同时癌细胞也能利用EVs纳米颗粒来控制其周围的细胞,同时抑制并操控宿主的免疫系统,研究者所开发的新技术能对黑色素瘤患者机体的血液样本进行检测,同时还能对癌症衍生的EVs进行检测,并在疗法期间和疗法后追踪患者体内所发生的改变。
研究者表示,他们很难有效区分癌细胞和健康细胞所释放EVs,癌细胞释放的EVs在血液中非常丰富,而研究者所开发的这种新技术或许就能将两种全新的方法整合到临床环境中用于潜在的治疗监测;他们能利用电激活的纳米流芯片来帮助捕捉癌细胞释放的EVs,同时还能将其与一种附着在抗体上的特殊类型的金纳米颗粒相结合,这种抗体能够吸附癌细胞EVs表面存在的特殊分子。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。