Nature论文解读!揭示帕金森病疾病风险和严重性与细胞溶酶体中的离子通道突变密切相关
来源:本站原创 2021-02-04 22:06
2021年2月4日讯/生物谷BIOON/---许多基因突变被发现与一个人患帕金森病的风险有关。然而对于这些突变中的大多数,它们的作用机制仍不清楚。如今,在一项新的研究中,来自美国宾夕法尼亚大学、中国复旦大学和北京大学的研究人员揭示了两种不同的突变---一种突变是增加疾病风险并导致帕金森病患者患上更严重的疾病,另一种突变是降低疾病风险---如何在体内表现出来。
2021年2月4日讯/生物谷BIOON/---许多基因突变被发现与一个人患帕金森病的风险有关。然而对于这些突变中的大多数,它们的作用机制仍不清楚。
如今,在一项新的研究中,来自美国宾夕法尼亚大学、中国复旦大学和北京大学的研究人员揭示了两种不同的突变---一种突变是增加疾病风险并导致帕金森病患者患上更严重的疾病,另一种突变是降低疾病风险---如何在体内表现出来。相关研究结果于2021年1月27日在线发表在Nature期刊上,论文标题为“A growth-factor-activated lysosomal K+ channel regulates Parkinson’s pathology”。
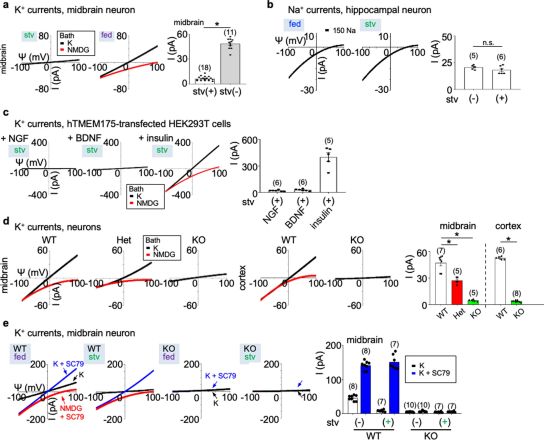
图片来自Nature, 2021, doi:10.1038/s41586-021-03185-z。
这项研究发现这种存在于大约17%的人体中的提高疾病风险的突变会导致称为溶酶体(lysosome)的细胞器中的一种离子通道功能下降。与此同时,一种让帕金森病风险降低约20%的不同突变存在于7%的普通人群中,会增强同一种离子通道的活性。
论文共同通讯作者、宾夕法尼亚大学文理学院生物系教授Dejian Ren说,“我们从基础生物学开始,想要了解溶酶体中的离子通道如何受到控制。但是,在这项研究中,我们发现这与帕金森病存在着明显的联系。观察到一种离子通道基因中的突变改变(增加或降低)患上帕金森病的几率是非常新颖的。”
这些研究人员指出,这种离子通道似乎在帕金森病中起着至关重要的作用,这一事实也使得它成为开发可以减缓这种疾病进展的药物的一种吸引人的潜在靶标。
科学家们自20世纪30年代以来就已经明白,细胞利用嵌入它的质膜中的受到精心调节的离子通道来控制它的生理学特性的关键方面,比如在神经元之间以及从神经元到肌肉的电脉冲穿梭。
但直到过去十年,人们才开始意识到,细胞内有膜的细胞器,包括内体和溶酶体,也是依靠离子通道进行交流的。
Ren说,“其中的一个原因是很难看清它们,这是因为细胞器真地很小。”在过去的几年里,他的实验室克服了这一技术挑战,开始研究这些膜离子通道,并测量穿过它们的离子电流。
这些离子通过在特定因素的作用下开启和关闭的离子通道蛋白。大约五年前,Ren的研究团队发现了一种称为TMEM175的膜蛋白,它形成了一个允许钾离子进出的离子通道。
大约在同一时间,其他开展全基因组关联研究的研究团队在TMEM175中发现了两种调高或调低帕金森病风险的突变。
Ren说,“其中的一种突变与普通人群患帕金森的几率增加20%~25%有关。如果你只观察那些已经被诊断出患有帕金森症的人,这种突变的频率会更高。”
因对这种联系很感兴趣,Ren找到了研究帕金森病患者的宾夕法尼亚大学医生科学家Alice Chen-Plotkin进行合作。在来自帕金森病患者的数据中,Chen-Plotkin和她的同事们发现,在那些携带Ren研究的TMEM175基因突变之一的患者中,运动和认知障碍进展更快。
为了找出这种突变在细胞中的实际作用,Ren实验室将目光投向了溶酶体。在孤立的情况下,他们发现通过TMEM175的钾离子电流被生长因子激活,这些生长因子是像胰岛素这样的蛋白,它们对体内营养物的存在做出反应。他们证实,TMEM175似乎是小鼠溶酶体中唯一活跃的钾通道。
Ren说,“当你让细胞饥饿时,这种蛋白就不再发挥作用了。这对我们来说是令人兴奋的,这是因为这告诉我们这是一个重要的机制,可以被这种细胞器用来接收来自细胞外部的通信信号,也许还可以将通信信号送回外面。”
他们发现,一种通常被认为在任何蛋白上添加一种叫做磷酸基团的小分子的叫做AKT的激酶与TMEM175一起开启这种蛋白通道。但是,AKT在没有引入磷酸基团的情况下开启了它。Ren说,“教科书上对激酶的定义是,它能使蛋白磷酸化。发现这种激酶在不做这种事情的情况下发挥作用是非常令人惊讶的。”
接下来,他们转向经过基因改造后携带与人类群体中发现的相同突变的小鼠,以便观察这种基因变化如何影响它们的离子通道活性。带有这种增强疾病风险的突变的小鼠体内的钾离子电流只有正常小鼠的50%左右,而且在没有生长因子的情况下,这种电流会消失。相比之下,在没有生长因子的情况下,携带这种降低疾病风险的突变的小鼠的离子通道持续运作了几个小时,甚至比正常小鼠的运作时间更长。
Ren说,“这告诉你这种突变在某种程度上帮助小鼠抵抗营养物枯竭的影响。”
为了衡量对神经元的影响,他们观察到,在细胞培养物中,携带这种与更严重的帕金森病相关的突变的神经元更容易受到毒素和营养物枯竭的损害。Ren说,“如果在人类神经元中也是如此,那么这就意味着17%的人群携带的一种突变可能会使他们的神经元在遭受应激时更容易受损。”
与宾夕法尼亚大学研究员Kelvin Luk合作,这些研究人员观察了体外培养的神经元中错误折叠蛋白的水平。在作为帕金森病的一个典型特征---人类路易体(Lewy body)---中,当TMEM175的功能下降时,这些内含物在神经元中“显著”增加。这很可能是由于溶酶体的功能受损。
而同样与人类帕金森病相关的是,缺乏TMEM175的小鼠失去了一部分产生神经递质多巴胺的神经元,而且在协调性测试上的表现也比正常小鼠差。
连同在人类身上的发现,这些研究人员认为他们的研究指出了帕金森病病理的一个重要因素。展望未来,Ren团队希望能够深入研究这种离子通道的调节机制。他们的研究不仅可能揭示帕金森病所涉及的分子损伤,还可能揭示其他神经退行性疾病---特别是那些与溶酶体有关的疾病,其中包括一些罕见但非常严重的疾病---所涉及的分子损伤。
他们还想知道,由于这种易感突变在如此多的人中携带,它是否也会影响其他基因突变对患帕金森症可能性的影响。(生物谷 Bioon.com)
参考资料:
1.Jinhong Wie et al. A growth-factor-activated lysosomal K+ channel regulates Parkinson's pathology. Nature, 2021, doi:10.1038/s41586-021-03185-z.
2.Parkinson's disease risk and severity is tied to a channel in cells' 'recycling centers
https://medicalxpress.com/news/2021-01-parkinson-disease-severity-tied-channel.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


