Nature子刊:云南大学杨崇林团队揭示丙酸代谢中间物D-2HG和3-HP损伤线粒体的机制
来源:生物世界 2022-04-20 09:55
研究团队发现 dhgd-1 和 hphd-1 突变体的线粒体缺陷受饮食/肠道细菌的影响。
线粒体是细胞的能量工厂和代谢中心。葡萄糖、脂肪酸和多种氨基酸在线粒体氧化分解时,产生多种有机酸类中间物。正常情况下,这些有机酸中间物通过三羧酸循环(TCA)氧化,或作为前体用于合成新的大分子,因而在细胞内的浓度很低。相关代谢酶的缺陷可导致体内有机酸过量累积,表现为血液和尿液中有机酸浓度增高,引起一大类严重的遗传代谢性疾病:有机酸血(尿)症。目前,有机酸血(尿)症的分子细胞学机理极不清楚。
D-2-羟基戊二酸(D-2HG)主要来源于TCA循环底物α-酮戊二酸(α-KG)的还原,其累积可导致D-2-羟基戊二酸尿症(D-2-HGA),该疾病是一种罕见的常染色体隐性遗传代谢障碍性疾病,表现为严重的发育迟缓、行进性神经损伤及大脑损害,但其致病机制一直是个谜团。此外,许多研究发现D-2HG可能通过诱导异常的组蛋白修饰和DNA甲基化进而促进肿瘤发生。尽管D-2HG产生于线粒体,但目前尚不清楚其对响线粒体结构和功能造成何种影响。与D-2HG相似,3-羟基丙酸(3-HP)也产生于线粒体,来源于丙酸及支链氨基酸在线粒体中的氧化代谢。3-HP异常累积是丙酸血症(PPA)和甲基丙二酸血症(MMA)等丙酸代谢疾病的特征性指标。迄今,3-HP是否以及如何影响线粒体的稳态尚不得而知。
近日,云南大学生命科学中心杨崇林实验室在 Nature Cell Biology 期刊发表了题为:A feedback loop engaging propionate catabolism intermediates controls mitochondrial morphology 的研究论文。
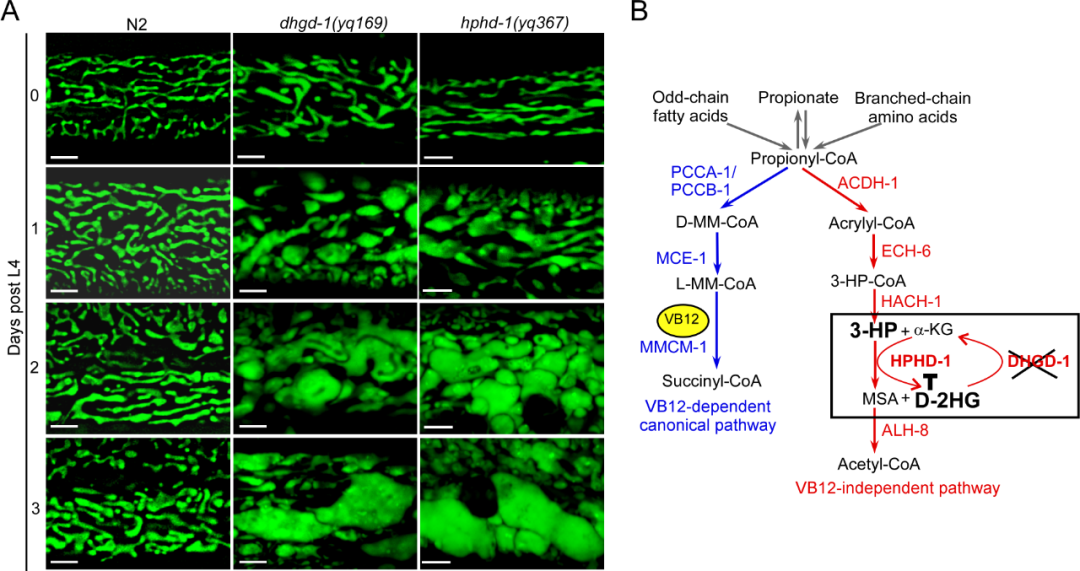
该研究以秀丽隐杆线虫为模式,发现 D-2HG 和 3-HP 的过量累积造成线粒体结构和功能的破坏,揭示了一个由 D-2HG 和 3-HP 构成的代谢反馈环及其破坏线粒体的分子和细胞生物学机制。在这个代谢反馈环中,过量累积的 D-2HG 结合3-羟基丙酸脱氢酶(HPHD-1),抑制其活性,导致3-HP的大量累积(图1)。3-HP 进而特异性地结合线粒体内外膜接触和嵴形成所必需的 MICOS 复合体的 Mic60/IMMT-1 亚基上,抑制 Mic60/IMMT-1 介导的内嵴形成,导致线粒体的损伤。
同时,研究团队发现饮食/肠道细菌可以调节宿主 3-HP 的产生,从而对宿主线粒体健康产生显著影响。该研究不仅首次揭示了 D-2HG 累积和丙酸分解代谢之间的反馈抑制关系,而且还为 D-2-HGA、PPA 和 MMA 等相关疾病的分子细胞生物学机制提供了重要线索。

在该项研究中,研究者首先建立了以线虫为模式的线粒体稳态研究系统。通过正向遗传筛选,发现编码 D-2HG 脱氢酶的基因 dhgd-1 的突变导致 D-2HG 的显著累积,并且线粒体呈现不规则增大并伴有空泡的异常结构。为了确定 D-2HG 是否是导致 dhgd-1 突变体的线粒体损伤的直接原因,研究者通过在 dhgd -1 突变体中引入 3-HP 脱氢酶基因 hphd-1 的突变来抑制 D-2HG 的产生。结果发现,dhgd-1 hphd-1 双突变体不再累积 D-2HG。令人惊讶的是,这些双突变体却表现出与 dhgd-1 单突变体相似的线粒体缺陷。此外,研究者通过非偏好性的突变体筛选,也鉴定了 hphd-1 的单突变体并发现其存在类似的线粒体缺陷。这些结果表明 D-2HG 并不是造成线粒体损伤的直接原因。
图1. A 线虫中编码D-2HG脱氢酶的基因dhgd-1的突变和3-HP脱氢酶基因hphd-1的突变导致线粒体结构异常。B 线虫支链氨基酸、丙酸、奇数链脂肪酸的代谢通路:依赖于VB12经典通路和不依赖于VB12 的通路。线虫在饲喂缺乏维生素 B12 的大肠杆菌 OP50(B-type E. coli)条件下,丙酸的分解代谢主要通过不依赖于VB12 的通路进行。在此代谢过程中,dhgd-1的功能缺失导致D-2HG的过量累积,D-2HG结合并抑制3-羟基丙酸脱氢酶(HPHD-1)的活性,进而造成3-HP的累积。
研究者进而推测 D-2HG 是否通过反馈抑制作用,导致其上游的代谢物 3-HP 的累积而损伤线粒体。通过 GC-MS 检测,他们发现 dhgd-1 和 hphd-1 突变体中 3-HP 的含量均显著增高。当补充 VB12 使丙酸通过依赖于 VB12 的经典途径降解时, 3-HP 的累积被抑制,进而使 dhgd-1 和 hphd-1 突变体中的线粒体恢复正常。这些结果证明异常积累的 3-HP 是导致线粒体结构和功能的损破坏的直接原因。
研究团队进一步证明了 D-2HG 与 HPHD-1 蛋白结合并抑制后者的脱氢酶活性。因此,在 dhgd-1 突变体中,过量累积的 D-2HG 对 HPHD-1 产生反馈抑制,导致 3-HP 的累积。通过脂质共沉淀实验,他们发现 3-HP 与 Mic60/IMMT-1 结合,而 a-KG 和 D-2HG 与 Mic60 的结合能力则要弱很多。3-HP 显著抑制 Mic60/IMMT-1 所介导的脂质体形变。在 dhgd-1 和 hphd-1 突变体中,过表达 Mic60/IMMT-1 回复了突变体的线粒体缺陷。这些体外和体内的实验结果表明,3-HP 靶向 Mic60/IMMT-1 而导致线粒体损伤。
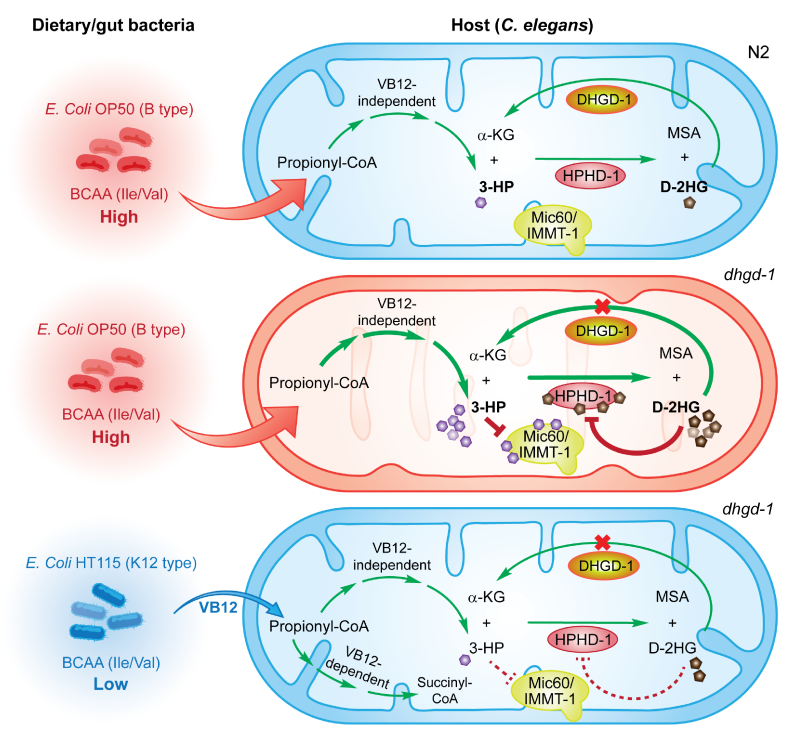
最后,研究团队发现 dhgd-1 和 hphd-1 突变体的线粒体缺陷受饮食/肠道细菌的影响。饲喂K12型大肠杆菌(如HT115)可使这些突变体的缺陷性线粒体恢复正常。HT115 大肠杆菌通过多种机制调节宿主 3-HP 的产生从而影响线粒体的结构与功能,包括激活依赖于 VB12 的丙酸代谢通路、减少宿主的丙酸来源(支链氨基酸)。这些结果为D-2HG和3-HP相关的人类疾病的治疗提供了重要思路(图2)。
图2 饮食/肠道细菌影响丙酸代谢中间物D-2HG和3-HP损伤线粒体的机制模型。在饲喂缺乏维生素 B12 的大肠杆菌 OP50(B-type)的线虫中,丙酸分解代谢主要经不依赖于VB12 的通路进行。其中,HPHD-1蛋白以3-HP和α-KG作为共同底物,生成丙二酸半醛(MSA)和D-2HG, 后者随即通过DHGD-1蛋白催化生成α-KG,避免D-2HG在体内过度累积(上)。在dhgd-1突变体中,过量累积的D-2HG对HPHD-1产生反馈抑制,导致3-HP的累积。过多的3-HP结合Mic60/IMMT-1蛋白,抑制其与线粒体内膜结合和内嵴形成,导致线粒体的损伤(中)。HT115大肠杆菌(K12-type)通过激活依赖于VB12的丙酸代谢通路,以及减少宿主的丙酸(支链氨基酸)等方式,抑制宿主3-HP的产生,从而改善线粒体的结构与功能(下)。
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->