STTT:重庆医科大学黄爱龙团队发现乙肝病毒促肝癌的新伎俩!
来源:奇点糕 2023-02-28 14:53
OGT抑制剂不仅在体内降低YTHDF2的O-GlcNAc糖基化水平、下调MCM2/5表达,更能有效减缓小鼠肝脏肿瘤发生的速度、缩小肿瘤体积,并减轻肝功能损伤水平。
据统计,全球超过一半的肝细胞癌(HCC)诱因是乙型肝炎病毒(HBV)慢性感染[1,2]。
然而,HBV感染引起HCC的分子机制,目前仍然没有完全弄清楚。这一现状严重阻碍了HBV相关HCC的预防和治疗。如果能深入了解背后机制,找到新的治疗靶点,对于改善HCC患者的预后无疑具有重要意义。
近日,由重庆医科大学病毒性肝炎研究所黄爱龙领衔的研究团队,在著名期刊Signal Transduction and Targeted Therapy发表研究论文[3],阐述了HBV感染引起HCC发生与进展的新机制。
具体来说,HBV感染能升高YTHDF2的氧连氮-乙酰葡萄糖胺(O-GlcNAc)糖基化修饰水平,让YTHDF2变得更稳定,这进一步又让参与细胞周期的MCM2和MCM5的mRNA变得更稳定,最终实现维持细胞周期和促进肝癌的进展。
本研究揭示了YTHDF2调节HCC发生与进展的全新机制,并为开发HBV感染相关的肝癌治疗靶点提供了理论基础。

论文截图
我们都知道,致癌病毒诱发肿瘤最常见的机制,便是将自身遗传物质整合至宿主基因组。但狡猾的HBV还是一种“代谢病毒”,能扰乱肝细胞的多种代谢通路,使肝细胞一路滑进肿瘤的深渊。
与己糖胺代谢通路相关的氧连氮-乙酰葡萄糖胺(O-GlcNAc)糖基化修饰,与其他多种病毒的致癌效应有关[4,5],在HBV感染后也有所升高[6]。
O-GlcNAc糖基化修饰是一种由O-GlcNAc转移酶(OGT)催化的蛋白翻译后修饰,而O-GlcNAc水解酶(OGA)负责移除GlcNAc。在多种被O-GlcNAc糖基化的宿主蛋白中,YTHDF2引起了研究人员的注意。大量的研究表明,YTHDF2可以识别mRNA上的N6-腺苷酸甲基化(m6A)修饰、有利于mRNA的稳定、促进其翻译[7-10]。
黄爱龙团队注意到,在HBV感染相关的HCC组织中,YTHDF2的O-GlcNAc糖基化水平随着总O-GlcNAc糖基化水平一同升高,且HCC组织的YTHDF2蛋白表达水平也高于非肿瘤组织。究其背后原因,原来HBV感染导致的O-GlcNAc糖基化修饰会增强YTHDF2的稳定性。
接下来就该看看YTHDF2在HCC中如何“助纣为虐”了。
YTHDF2所含的YTH结构域能特异性识别RNA的m6A修饰位点,但这一亲和力并不会随着YTHDF2的O-GlcNAc糖基化水平改变而改变。虽然O-GlcNAc糖基化并不会直接影响YTHDF2的功能,但蛋白的稳定性增加,就可以更长久地发挥作用。
在感染HBV的细胞中,敲降YTHDF2可抑制细胞增殖、侵袭和迁移,还能抑制成瘤,重新表达野生型YTHDF2可恢复细胞的上述活动,但重新表达S263A突变体则不改变敲降效应。也就是说,HBV感染引起HCC,要抓的不光是YTHDF2,还得是O-GlcNAc糖基化的YTHDF2。
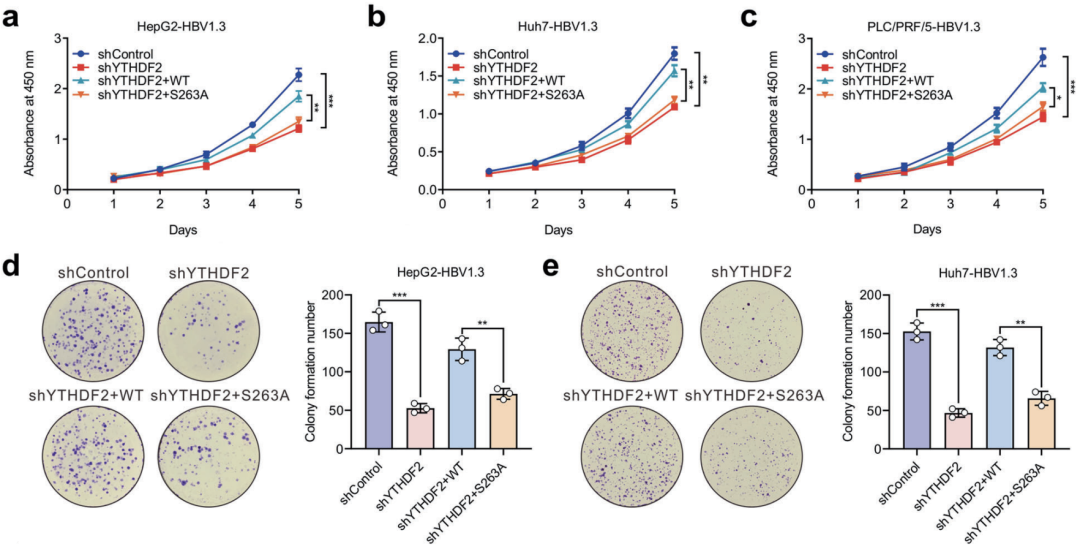
YTHDF2敲降与重新表达,对细胞增殖的影响
看到这里你可能也想问,m6A修饰的mRNA有那么多,到底哪些是和HCC有关的呢?
研究人员针对HBV感染的HepG2细胞,用RNA-seq、m6A-seq和RNA免疫共沉淀(RIP-seq)探究了YTHDF2的靶基因。结合三种测序的差异基因交集和RT-qPCR验证,MCM2和MCM5浮出了水面。

RNA-seq、m6A-seq和RIP-seq差异基因韦恩图
MCM2/5对于DNA复制的启动至关重要,有助于维持正常的细胞周期[11,12]。
进一步的实验表明,MCM2/5的mRNA和蛋白水平都与YTHDF2的O-GlcNAc糖基化水平正相关,且YTHDF2的O-GlcNAc糖基化有利于MCM2/5 mRNA增强3' UTR活性、延长半衰期。
而失去m6A识别能力的YTHDF2 W432A突变体与MCM2/5的相互作用比野生型更弱,也无法增加MCM2/5的表达。也就是说,在HBV感染相关HCC中,O-GlcNAc糖基化的YTHDF2通过识别m6A,稳定MCM2/5转录本,从而促进肿瘤发生与进展。
不过,研究人员并没有就此停下探寻的脚步,他们还利用多种HCC动物模型进一步验证了前述细胞实验的结论,并且检验了O-GlcNAc转移酶OGT作为HBV相关HCC治疗靶点的潜能。
他们发现,OGT抑制剂不仅在体内降低YTHDF2的O-GlcNAc糖基化水平、下调MCM2/5表达,更能有效减缓小鼠肝脏肿瘤发生的速度、缩小肿瘤体积,并减轻肝功能损伤水平。在HCC患者中,也是YTHDF2和MCM2/MCM5水平较高的患者总生存期更短。
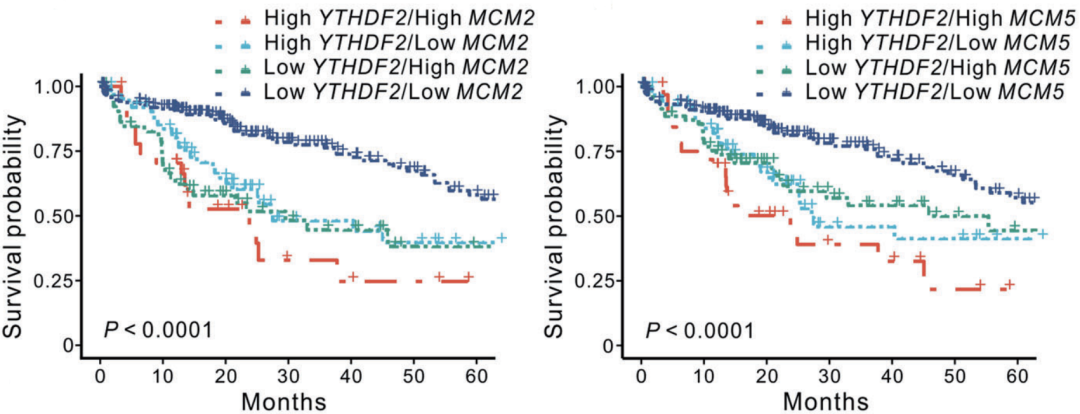
YTHDF2和MCM2/MCM5表达水平不同的HCC患者总生存期
基于本研究,靶向YTHDF2及其O-GlcNAc糖基化来干预HBV相关HCC,或许可以成为一个新的治疗思路。
参考文献:
[1] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249. doi:10.3322/caac.21660
[2] Jia L, Gao Y, He Y, Hooper JD, Yang P. HBV induced hepatocellular carcinoma and related potential immunotherapy. Pharmacol Res. 2020;159:104992. doi:10.1016/j.phrs.2020.104992
[3] Yang Y, Yan Y, Yin J, et al. O-GlcNAcylation of YTHDF2 promotes HBV-related hepatocellular carcinoma progression in an N6-methyladenosine-dependent manner. Signal Transduct Target Ther. 2023;8(1):63. Published 2023 Feb 10. doi:10.1038/s41392-023-01316-8
[4] Groussaud D, Khair M, Tollenaere AI, et al. Hijacking of the O-GlcNAcZYME complex by the HTLV-1 Tax oncoprotein facilitates viral transcription. PLoS Pathog. 2017;13(7):e1006518. Published 2017 Jul 24. doi:10.1371/journal.ppat.1006518
[5] Zeng Q, Zhao RX, Chen J, et al. O-linked GlcNAcylation elevated by HPV E6 mediates viral oncogenesis. Proc Natl Acad Sci U S A. 2016;113(33):9333-9338. doi:10.1073/pnas.1606801113
[6] Hu J, Gao Q, Yang Y, et al. Hexosamine biosynthetic pathway promotes the antiviral activity of SAMHD1 by enhancing O-GlcNAc transferase-mediated protein O-GlcNAcylation. Theranostics. 2021;11(2):805-823. Published 2021 Jan 1. doi:10.7150/thno.50230
[7] Zhu T, Roundtree IA, Wang P, et al. Crystal structure of the YTH domain of YTHDF2 reveals mechanism for recognition of N6-methyladenosine. Cell Res. 2014;24(12):1493-1496. doi:10.1038/cr.2014.152
[8] Wang X, Lu Z, Gomez A, et al. N6-methyladenosine-dependent regulation of messenger RNA stability. Nature. 2014;505(7481):117-120. doi:10.1038/nature12730
[9] Du H, Zhao Y, He J, et al. YTHDF2 destabilizes m(6)A-containing RNA through direct recruitment of the CCR4-NOT deadenylase complex. Nat Commun. 2016;7:12626. Published 2016 Aug 25. doi:10.1038/ncomms12626
[10] Zhang C, Huang S, Zhuang H, et al. YTHDF2 promotes the liver cancer stem cell phenotype and cancer metastasis by regulating OCT4 expression via m6A RNA methylation. Oncogene. 2020;39(23):4507-4518. doi:10.1038/s41388-020-1303-7
[11] Petropoulos M, Champeris Tsaniras S, Taraviras S, Lygerou Z. Replication Licensing Aberrations, Replication Stress, and Genomic Instability. Trends Biochem Sci. 2019;44(9):752-764. doi:10.1016/j.tibs.2019.03.011
[12] Yu S, Wang G, Shi Y, Xu H, Zheng Y, Chen Y. MCMs in Cancer: Prognostic Potential and Mechanisms. Anal Cell Pathol (Amst). 2020;2020:3750294. Published 2020 Feb 3. doi:10.1155/2020/3750294
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


