《JAMA·肿瘤学》:让最毒乳腺癌和卵巢癌的发病风险翻倍,BRCA1的这个变化要警惕!
来源:奇点糕 2022-11-14 10:18
,基线有WBC BRCA1启动子区甲基化的受试者,将来更容易患TNBC和HGSOC,HR分别为2.35和1.93。也就是说健康绝经后女性,有WBC BRCA1启动子区甲基化的个体将来患TNBC和HGS
众所周知,抑癌基因BRCA1胚系致病性基因突变会显著增加女性患乳腺癌和卵巢癌的风险[1]。机制上,BRCA1胚系突变引起BRCA1表达或功能受损,从而削弱同源重组修复系统,导致DNA损伤累积,甚至三阴性乳腺癌(TNBC)和高级别浆液性卵巢癌(HGSOC)的发生[2-3]。
然而,有相当一定比例的同源重组修复缺陷(HRD)阳性的TNBC和HGSOC没有BRCA1突变,但是具有BRCA1启动子区甲基化。据统计,分别有25-30%的TNBC和10-20%的HGSOC患者,确诊时可检测到BRCA1启动子区甲基化,且与BRAC1突变互斥。考虑到BRCA1启动子区甲基化也与HRD阳性密切相关,它很可能是肿瘤发生和演进的早期事件,甚至是肿瘤发生的始动因素。
有研究人员推测,肿瘤组织的BRCA1启动子区甲基化,可能是全身BRCA1组成型甲基化的结果[4-5]。但是,上述只是理论推测,BRCA1组成型甲基化与TNBC和HGSOC的关系还没有被真正探究过。
近日,来自挪威卑尔根大学临床科学部的Per E Lønning教授团队,进行了一项概念验证研究(POC study):探究白细胞(WBC)BRCA1启动子区甲基化与后续TNBC和HGSOC的发病风险是否相关[6]。结果表明,在绝经后的健康女性中,BRCA1组成型甲基化导致患TNBC和HGSOC的风险分别增加135%和93%。相关研究成果发表在著名期刊JAMA Oncology上。

论文首页截图
接下来我们就一起来看看这个研究是如何展开的。
研究人员针对TNBC和HGSOC各开展了一项巢式病例对照研究,总队列为美国女性健康促进临床试验(the WHI clinical trial)的161808位健康受试者。
她们均为绝经后女性,50-79岁,于1993年至1998年在全美40家临床中心入组,收集人口学特征、医疗史、生育史、家族史等基线信息,入组时抽取空腹12小时后血液,离心分装白细胞保存于-80°C冰箱,并分批进行DNA抽提,每半年或一年随防健康状况。
最终,TNBC筛选出了636例病例:1838例对照(1:3匹配,有些病例不足3例对照),HGSOC筛选出了509例病例:2979例对照(1:6匹配,有些病例不足6例对照),其中5例患者既患有TNBC、又患有HGSOC,1272例健康受试者既是TNBC的对照、又是HGSOC的对照。
病例-对照匹配筛选流程图
研究人员选取了WBC BRCA1启动子区的50个CpG位点进行甲基化检测,测序深度>20000×。经分析,判定为WBC BRCA1启动子区甲基化的受试者人数分别为:636例TNBC中有79例,1838例TNBC对照中有104例;509例HGSOC中有48例,2979例HGSOC对照中有156例。
但是,白细胞中检测到的BRCA1启动子区甲基化,能代表乳腺、卵巢细胞也存在BRCA1启动子区甲基化么?能,如果白细胞的BRCA1是组成型甲基化,那就很可能乳腺、卵巢细胞也发生了BRCA1组成型甲基化。
测序结果分析表明,WBC的BRCA1启动子区甲基化呈现出组成型甲基化的特点:单个受试者内,所有WBC的两个BRCA1等位基因,分别具有各自相同均一的启动子区甲基化模式,也就是说所有WBC的BRCA1启动子区甲基化模式复制自一个共同的祖细胞。这一特点使先天性组成型甲基化,区别于后天形成的非均一的甲基化。

接下来研究人员运用COX比例风险回归模型,分析WBC BRCA1启动子区甲基化是否增加TNBC、HGSOC的发病风险。以基线有无WBC甲基化分为两组,以抽血入组为观测起点,以诊断TNBC或HGSOC为观测终点,随访日期截至2018年3月31日,计算基线有WBC甲基化组vs基线无WBC甲基化组,发生终点事件的风险比(HR)。
结果表明,基线有WBC BRCA1启动子区甲基化的受试者,将来更容易患TNBC和HGSOC,HR分别为2.35和1.93。也就是说健康绝经后女性,有WBC BRCA1启动子区甲基化的个体将来患TNBC和HGSOC的风险是无WBC BRCA1启动子区甲基化个体的2.35倍(图3)和1.93倍(图4)。
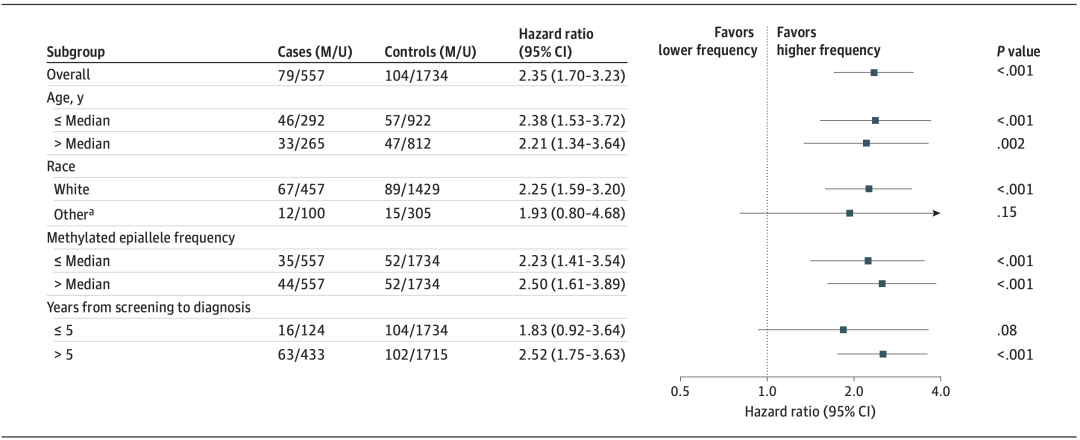
图3. WBC BRCA1启动子区甲基化与将来发生TNBC的风险比
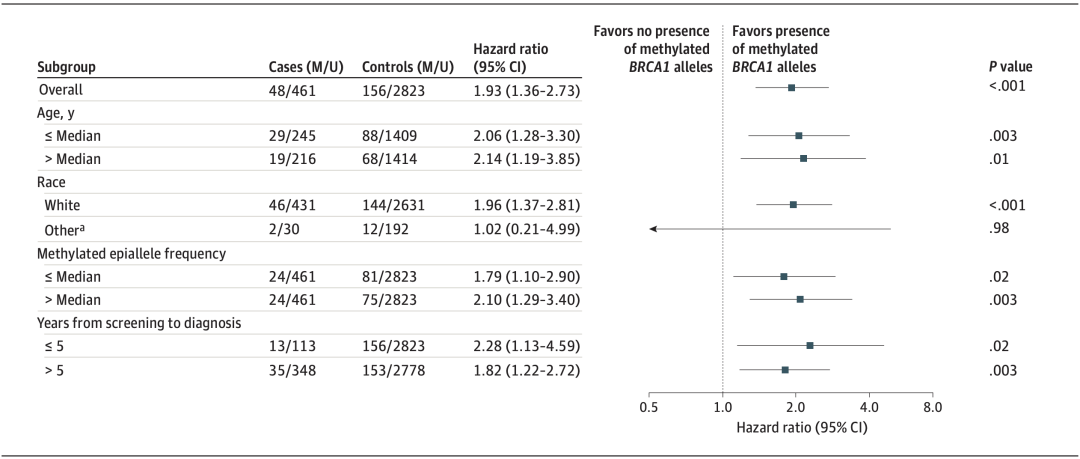
图4. WBC BRCA1启动子区甲基化与将来发生HGSOC的风险比
而且,按照肿瘤诊断时间、年龄、甲基化程度等亚组分析和敏感性分析,所得HR趋势均相同,约为2倍。
由于BRCA1组成型甲基化在年轻女性中更常见[2],且TNBC、HGSOC主要发生于年轻女性,所以BRCA1组成型甲基化在年轻女性中增加的TNBC和HGSOC患癌风险可能更高。因此,有必要对WBC BRCA1启动子区甲基化的女性,尤其年轻女性,开展更早、更密切的乳腺癌、卵巢癌筛查。
作为一项POC研究,这篇文章提出抑癌基因BRCA1组成型甲基化增加患癌风险的概念,巧妙严谨地设计了TNBC和HGSOC两种肿瘤分别的巢式病例对照研究,有力证实了这一概念。这项发现同时提醒我们,抑癌基因组成型甲基化和泛肿瘤风险的关系值得深入研究。
最后,该研究提供了前瞻性预测肿瘤发生的一种新变量、新维度,使目前液体活检领域如火如荼的ctDNA甲基化诊断肿瘤在概念上又向前迈进了一小步,从诊断到预测,从已病到未病。
参考文献:
[1]. Kuchenbaecker KB, Hopper JL, Barnes DR, et al. Risks of Breast, Ovarian, and Contralateral Breast Cancer for BRCA1 and BRCA2 Mutation Carriers. JAMA. 2017;317(23):2402-2416. doi:10.1001/jama.2017.7112
[2]. Walsh T, Gulsuner S, Lee MK, et al. Inherited predisposition to breast cancer in the Carolina Breast Cancer Study. NPJ Breast Cancer. 2021;7(1):6. Published 2021 Jan 21. doi:10.1038/s41523-020-00214-4
[3]. Lønning PE, Berge EO, Bjørnslett M, et al. White Blood Cell BRCA1 Promoter Methylation Status and Ovarian Cancer Risk. Ann Intern Med. 2018;168(5):326-334. doi:10.7326/M17-0101
[4]. Lønning PE, Eikesdal HP, Løes IM, Knappskog S. Constitutional Mosaic Epimutations - a hidden cause of cancer?. Cell Stress. 2019;3(4):118-135. Published 2019 Mar 22. doi:10.15698/cst2019.04.183
[5]. Hitchins MP. Constitutional epimutation as a mechanism for cancer causality and heritability?. Nat Rev Cancer. 2015;15(10):625-634. doi:10.1038/nrc4001
[6]. Lønning PE, Nikolaienko O, Pan K, et al. Constitutional BRCA1 Methylation and Risk of Incident Triple-Negative Breast Cancer and High-grade Serous Ovarian Cancer [published online ahead of print, 2022 Sep 8]. JAMA Oncol. 2022;e223846. doi:10.1001/jamaoncol.2022.3846
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


