肠道干细胞研究进展(第3期)
来源:生物谷原创 2022-08-30 11:25
从分子的角度来看,肠道是一个嘈杂的地方,各种人类细胞和微生物细胞彼此之间相互沟通,从而维持一种稳健而又健康的细胞群落。
从分子的角度来看,肠道是一个嘈杂的地方,各种人类细胞和微生物细胞彼此之间相互沟通,从而维持一种稳健而又健康的细胞群落。这个细胞群落的关键是肠道干细胞(intestinal stem cell),它们产生多种细胞类型,从而有助于保持肠道功能正常。肠道干细胞位于肠黏膜隐窝基底部,即基底隐窝是肠道干细胞的细胞库。正常情况下,位于隐窝基底部的肠道干细胞不断向隐窝顶部(肠腔方向)迁移,整个迁移过程大约3至5天,在迁移过程中肠道干细胞分化形成不同的肠粘膜细胞。
针对肠道干细胞研究近期取得的进展,小编进行了一番盘点,以飨读者。
1.Cell Stem Cell:揭示了机体肠道修复损伤组织的新型分子机制
doi:10.1016/j.stem.2022.07.007
肠道上皮组织会经历持续的更新并且在受损后具有特殊的再生能力;近日,一篇发表在国际杂志Cell Stem Cell上题为“Lymphangiocrine signals are required for proper intestinal repair after cytotoxic injury”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究在肠道中识别出了一种特殊组分或许在修复损伤组织上扮演着关键角色。
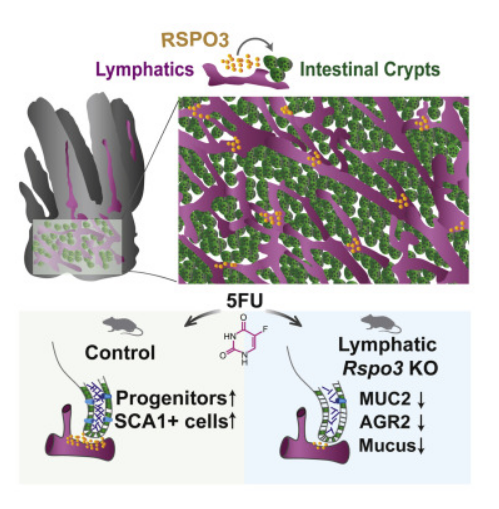
揭示了机体肠道修复损伤组织的新型分子机制。图片来源:Cell Stem Cell (2022). DOI: 10.1016/j.stem.2022.07.007。
本文中,研究者发现,淋巴管的内皮细胞或能产生特殊的分子,该分子对于肠道中干细胞和组织的维持和调节非常必要,这些淋巴内皮细胞能驻留在专门的干细胞生境附近,即支持干细胞再生的微环境。医学博士Ophir Klein说道,对于我们而言,理解生境以及淋巴细胞如何与干细胞交流沟通是非常重要的,解析了其中的机制或许能帮助解释支持干细胞的生态系统如何发挥作用从而为未来研究打下基础,未来或有望帮助开发修复机体损伤组织的新型治疗性策略。
为了更好地理解干细胞的活性,研究人员就想通过研究分析哪些细胞能帮助肠道上皮细胞来修复自身,尤其是淋巴内皮细胞;研究者Brisa Palikuqi说道,淋巴管与干细胞实际上非常亲近,几乎所有的干细胞区室都靠近淋巴管,由于这两种细胞类型如此接近,这或许就能让研究人员相信这些淋巴管或许在其中扮演着关键角色。淋巴管能表达多种跟银子,包括名为Rspo3基因,其被认为对于干细胞发挥功能非常重要,为了确定是否该基因在肠道干细胞调节过程中扮演重要角色,研究人员提出了消除机体中的Rspo3基因,并利用单细胞测序技术来观察肠道中的干细胞是如何在没有Rspo3基因存在的情况下产生反应的。
最开始,干细胞并不会对环境中的改变产生任何反应,随后研究人员就决定通过提供一种化疗药物来损伤该系统,该药物能在机体任何地方杀死任何增殖的细胞。当研究人员这样做时,突然间干细胞和肠道就不得不增加增殖量,从而每天替换掉更多的细胞。Rspo3基因的缺失会导致干祖细胞的数量下降,从而就会阻碍损伤后的机体组织恢复。这一研究发现或许就表明,淋巴内皮细胞是肠道生境的关键组分,同时在诸如化疗等损伤后对于肠道组织的修复非常重要。
2.Nature:重大进展!发现调节肠道上皮中干细胞的新机制
doi:10.1038/s41586-022-04962-0
覆盖在小肠和大肠内部的一层特殊细胞吸收营养物和水,同时阻止任何有害物质循环。这层细胞被称为肠道上皮。它每四到七天利用肠道干细胞完全自我更新。但是,科学家们仍然不知道这些干细胞究竟是如何发挥作用的。在一项新的研究中,来自荷兰癌症研究所、奥地利科学技术研究所、芬兰赫尔辛基大学、瑞典卡罗琳学院和英国剑桥大学的研究人员研究了肠道上皮中的干细胞。他们发现了一个令人兴奋的新机制,可能改变人们对什么是干细胞的理解。相关研究结果于2022年7月13日在线发表在Nature期刊上,论文标题为“Retrograde movements determine effective stem cell numbers in the intestine”。
肠道上皮只有一层细胞的厚度,并不断地更新。它遍布绒毛,这些绒毛看起来像覆盖在小肠和大肠内部的微小触角。在绒毛之间,有称为肠隐窝(intestinal crypt)的微小口袋。这个名字让人感到神秘,这很好地描述了那里到底发生了什么。论文共同第一作者Bernat Corominas-Murtra解释说,“在隐窝的底部,肠道上皮中的干细胞不断分裂。所产生的一些细胞作为干细胞留在隐窝中,其他细胞则被推向周围绒毛的顶端,在那里,它们最终分化为让肠道发挥功能的功能性细胞类型,并在几天后被丢弃。这种情况一直在人体内发生,如果这种机制崩溃,人体会遇到严重的医学问题。”
在研究小肠和大肠中的这些干细胞时,这些作者最初感到很困惑。Corominas-Murtra说,“我们通常对干细胞的看法是,干细胞是由细胞固有的生化特性决定的---类似于我们可以识别的生化标志物一样。我们发现在具有经典干细胞标志物的细胞中,许多细胞实际上从未作为干细胞发挥作用,而是被挤出隐窝并被丢弃,对肠道的长期更新没有任何贡献。我们还看到,虽然经典标志物预测小肠和大肠中的干细胞数量大致相同,但小肠中实际作为干细胞发挥作用的干细胞数量约为大肠中的两倍。”
因此,这些作者想了解是什么决定了哪些细胞真正作为干细胞发挥作用,他们吃惊地发现了一种调节隐窝中干细胞的新机制。Corominas-Murtra解释说,“我们发现,这些细胞是否表现为干细胞,完全取决于它们所处的位置。肠道上皮中的细胞不只是被它们下面的细胞分裂从隐窝向外推,就像在传送带上一样,而且还涉及到另一种运动。”这些作者发现,肠道上皮层中的细胞也积极地沿着随机方向移动---沿着传送带来回移动。这样一来,已经沿着传送带被向外推的细胞最终可以回到隐窝的底部,并在那里再次充当干细胞,进行分裂和补充肠道上皮层。
3.Cell Rep:微生物通过免疫依赖性调节肠道干细胞分化
doi:10.1016/j.celrep.2022.110572
近日,康奈尔大学的研究者们在“Cell Report”杂志上发表了题为“Microbes affect gut epithelial cell composition through immune-dependent regulation of intestinal stem cell differentiation”的文章,在本研究中研究者提出了一个模型,微生物模式识别途径(如IMD-AREISH)和损伤反应途径(如JAK-STAT)的平衡影响ISC的分化、上皮成分和肠道生理。
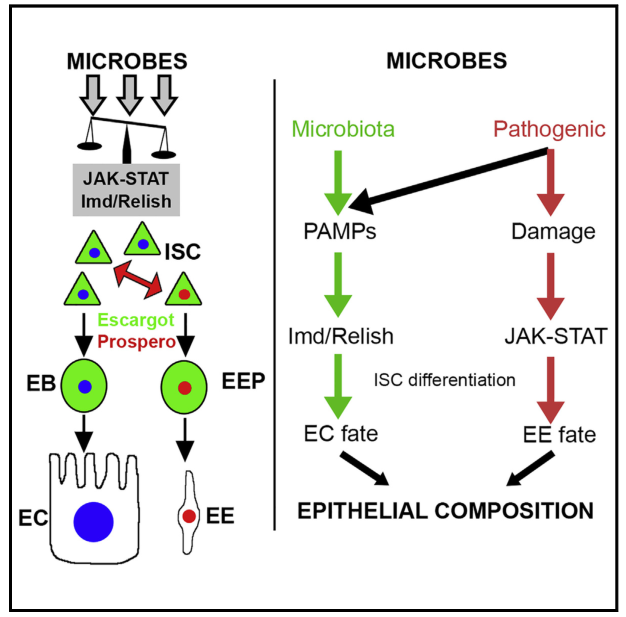
微生物通过免疫依赖性调节肠道干细胞分化影响肠道上皮细胞组成。图片来源: https://doi.org/10.1016/j.celrep.2022.110572
肠道微生物在宿主生理中扮演着重要的角色,然而,其影响的机制仍未得到充分的研究。在本研究中,研究者证明微生物不仅影响肠道生理,而且还改变其上皮成分。微生物区系和病原体共同影响肠道干细胞(ISC)的分化。有趣的是,虽然微生物区系促进ISC分化为肠细胞(EC),但病原体刺激肠内分泌细胞(EE)的命运和EES在中肠上皮的长期积累。重要的是,进化保守的果蝇NFKB(味觉)通过直接调节分化因子将干细胞谱系规范推向内皮细胞。相反,JAK-STAT通路促进EE对感染性损伤的命运。
为了进一步阐明微生物区系和病原体的这种差异影响,研究者应用互补基因组学方法来表征致病/非致病微生物对两条免疫途径:NFKB和JAK-STAT途径的影响。研究者发现,微生物主要刺激IMD-AREISH通路,而病原体则触发IMdRelish和JAK-STAT通路的激活。突变分析和功能遗传学实验揭示了保守的免疫途径在控制ISC分化中的重要作用。最后,通过研究这些保守的免疫通路之间的关系,研究者发现损伤介导的JAK-STAT激活拮抗了NFKB对ISC谱系的影响。
4.Nature Metabolism封面论文揭示不健康饮食引起的肠道干细胞功能改变导致肥胖和前驱糖尿病机制
doi:10.1038/s42255-021-00458-9
肠道对于维持我们的能量平衡至关重要,它是对营养平衡的变化做出快速反应的高手。它在肠道细胞的帮助下设法做到这一点,而这些肠道细胞主要负责吸收食物成分或分泌激素。在成年人类中,肠道细胞每五到七天就会再生一次。肠道干细胞不断更新和产生所有类型的肠道细胞的能力对于这种消化系统的天然适应性至关重要。然而,长期的高糖和高脂肪饮食破坏了这种适应性,并可能导致肥胖、2型糖尿病和胃肠道癌症的产生。
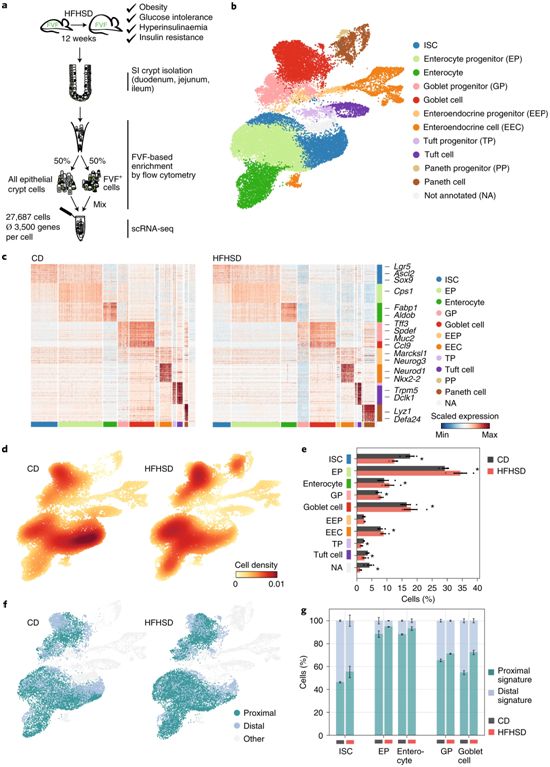 高糖和高脂肪饮食改变了肠道干细胞的谱系分配,改变了细胞的区域特性。图片来自Nature Metabolism, 2021, doi:10.1038/s42255-021-00458-9。
高糖和高脂肪饮食改变了肠道干细胞的谱系分配,改变了细胞的区域特性。图片来自Nature Metabolism, 2021, doi:10.1038/s42255-021-00458-9。
在一项新的研究中,来自德国亥姆霍兹慕尼黑中心、慕尼黑工业大学和德国糖尿病研究中心的研究人员猜测肠道干细胞在这种适应不良中发挥了特殊作用。通过使用一种小鼠模型,他们研究了高糖和高脂肪饮食的影响,并与对照组进行了比较。相关研究结果近期发表在Nature Metabolism期刊上,论文标题为“Diet-induced alteration of intestinal stem cell function underlies obesity and prediabetes in mice”。论文通讯作者为亥姆霍兹慕尼黑中心的Heiko Lickert、Anika Böttcher和Fabian J. Theis。
5.Nature:开发出一种名为Red2Onco的多色报道模型来追踪肠道干细胞生境的致癌驱动重塑机制
doi:10.1038/s41586-021-03605-0
肿瘤细胞和周围微环境之间的相互作用会促进肿瘤进展、转移和复发,尽管对果蝇的镶嵌分析能帮助研究人员理解这种相互作用,但在脊椎动物机体中设计出平行的研究方法依然比较困难;日前,一篇发表在国际杂志Nature上题为“Tracing oncogene-driven remodelling of the intestinal stem cell niche”的研究报告中,来自剑桥大学等机构的科学家们通过研究开发出了一种创新性的遗传小鼠模型—Red2Onco,其就能帮助检测诱发癌症的最初步骤,Red2Onco的多色标记系统能在单细胞水平上追踪第一次癌变打击后机体肠道中肿瘤的进展程度。
对癌症的研究一直受到了细胞转变成为临床可检测的阈值的限制;然而,通过恶性肿瘤的最初阶段在组织学上往往是看不见的,因为这一过程源于单一细胞,在早期阶段,一种所谓的“播种细胞”的过程能获得最初的促癌突变,这也被称为“第一次致癌打击”,同时会被正常的组织完全围绕;为了克服这种障碍,文章中,研究人员就开发了一种实验室系统来解析直到现在科学家们仍然未发现的癌前病变步骤。
研究者Bon-Kyoung Koo说道,随着诸如深度靶向性DNA测序技术的进展,如今科学家们已经注意到了与癌症相关的突变也会出现在正常组织中;而这是非常可怕的;这一转折点就像侦探一样,开始追踪第一个致癌打击。由于大多数人类癌症类型都源于上皮细胞,于是研究人员就决定建立一种遗传模型来分析小鼠机体肠道中首个致癌转化所产生的影响。这种名为Red2Onco的遗传模型是一种多色标记技术,其能帮助追踪从单一突变细胞开始的肿瘤进展过程。在Red2Onco的帮助下,研究人员发现,突变的细胞能为其邻近的非突变细胞创造一种敌对的环境,并大规模地解除对小鼠肠道组织中正常干细胞生境的调节,这是迄今为止研究人员所尝试的最让他们兴奋的方法了。
利用Red2Onco模型,研究人员就能研究两种独立的“首个致癌打击”所开启的机制,这两种“致癌打击”是两种已知能的原癌基因KRAS和PI3K,其被称为能驱动肿瘤发生的促癌因子;让研究人员意外的是,他们发现,即使在这种第一次致癌打击的情况下,突变的癌前细胞或播种细胞依然会对其邻居产生消极的影响。周围的正常组织会丢失其干细胞,这反过来有利于致癌突变干细胞及其后代的扩展;通过这种转化过程,突变细胞在肠道中的定植就会增加后期致癌的机会,这或许就会诱发癌症。
6.PNAS: miRNA靶向BMP信号可以调节肠道干细胞数量
doi: 10.1073/pnas.2022583118
印第安纳大学研究者在PNAS上发表了题为"A stress-responsive miRNA regulates BMP signaling to maintain tissue homeostasis"的文章。成年生物必须感知并适应环境的波动。在肠道等高周转率的组织中,这些适应性反应需要基因表达的快速变化,而这反过来可能涉及转录后基因控制。然而,肠组织特异性microRNA(MiRNA)介导的调控途径仍未被探索。在本研究中作者确定了一种转录后机制,即在正常内稳态和组织再生期间调节果蝇成体肠道组织中的BMP信号活性,从而调节肠道干细胞数量。
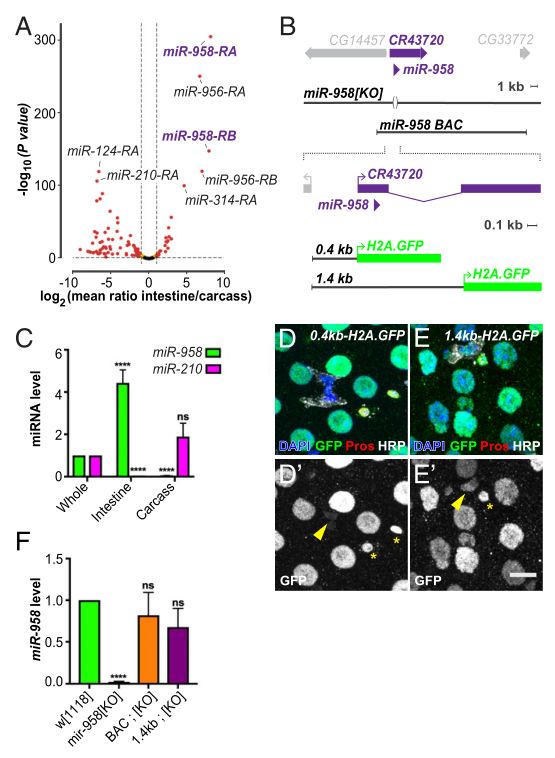 MIR-958在果蝇肠道组织中富集。图片链接:https://doi.org/10.1073/pnas.2022583118
MIR-958在果蝇肠道组织中富集。图片链接:https://doi.org/10.1073/pnas.2022583118在这项研究中,这些作者通过对果蝇肠道组织的分析,鉴定了一种肠道特异的miRNA,miR-958,并研究了它在组织稳态和再生方面的作用。他们发现miR-958调节一个直接靶点Cabut(CBT),以调节BMP信号,而BMP信号又调节干细胞数量。他们还表明miR-958水平是应激反应的,因此作者确定了果蝇成体中肠适应性组织反应的机制。
7.Nature子刊解读!科学家深度解析肠道干细胞自我更新和分化的基本分子机制!
doi:10.1038/s41556-020-00617-2
近日,一篇刊登在国际杂志Nature Cell Biology上题为“Non-canonical Wnt/PCP signaling regulates intestinal stem cell lineage priming towards enteroendocrine and Paneth cell fates”的研究报告中,来自德国环境健康研究中心等机构的科学家们通过研究解开了肠道干细胞自我更新和分化的分子机制。肠道在调节机体代谢和与多种疾病相关的异常表现上扮演着关键的角色,比如影响全球数百万人机体健康的肥胖、糖尿病、结肠炎和结直肠癌;通过刺激来自肠道干细胞的特定肠内分泌细胞的形成来早期靶向作用内分泌功能障碍或许有望作为一种治疗糖尿病的再生医学疗法,基于此,详细阐明肠道干细胞系的谱系结构以及调节招募不同肠道细胞类型的特殊信号就显得尤为重要。
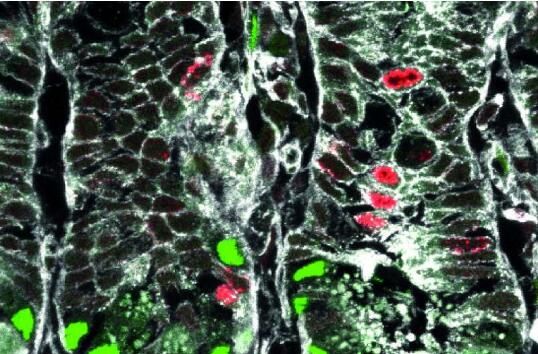
图片来源:Helmholtz Zentrum München
为何肠道对机体健康研究如此重要?研究者Heiko Lickert说道,作为机体的消化和最大的内分泌系统,肠道在机体能量的调节和葡萄糖平衡上扮演着重要角色,肠道的功能是由专门的细胞来完成的,这些细胞每隔3-4天就会从肠道干细胞中不断产生并更新;比如,所谓的肠道内分泌细胞就能产生20多种不同的激素,并向大脑和胰腺发送信号来调节食欲、食物摄取、胃的排空和来自胰腺β细胞的胰岛素分泌。
另外一项重要的肠道功能是通过所谓的潘氏细胞(Paneth cells)来发挥的,这些细胞能够产生防御素并保护机体抵御外来病原体的入侵;因此,肠道功能异常与多种疾病有关这就毫不奇怪了,比如慢性炎症、结直肠癌、糖尿病等影响着全球数百万人健康的疾病。文章中,研究人员深入理解了肠道干细胞如何持续更新并以前所未有的单细胞分辨率不断产生特殊的细胞类型,如今研究人员就能够描述每个肠道细胞的潜在祖细胞群,而且他们指出,每个谱系的肠道干细胞都能够产生单能性的祖细胞。
此外,研究人员还识别出了一种特定的肠道干细胞生境信号通路(Wnt/planar细胞极性通路),其能调节肠道干细胞的自我更新和谱系决策。这一点非常重要,因为肠道干细胞能够无限更新并维持肠道功能和组织的屏障,机体有着6米长的上皮组织,而且每天会产生超过1亿个细胞,此外,这些细胞能够分化为每一种细胞类型,因此,这种自我更新或谱系决策过程的失败所导致慢性疾病的风险是相当高的。
8.厦大Nature:基因不稳定导致肠道干细胞坏死诱发肠道炎症
doi:10.1038/s41586-020-2127-x
炎症性肠病(infammatory bowel disease,IBD)的病因包含遗传和环境之间的多因素相互作用导致。近日来自厦门大学细胞应激生物学国家重点实验室、生命科学学院莫玮教授课题组和韩家淮院士课题组合作在Nature杂志上发文揭示了肠道干细胞中基因组不稳定性引发干细胞坏死,导致自发性的肠道炎症的机制,该文章题为"Gut stem cell necroptosis by genome instability triggers bowel inflammation",研究人员发现了一种组蛋白甲基转移酶SETDB1的缺失,会介导赖氨酸9处组蛋白H3的三甲基化,从而参与IBD的发病机制。
研究人员发现,IBD患者的SETDB1水平下降,而肠道干细胞中SETDB1水平下降的小鼠会发生自发性末端回肠炎和结肠炎。SETDB1保护了基因组的稳定性,肠干细胞中SETDB1的缺失释放了对内源性逆转录病毒的抑制(在人类中,长时间重复的类似逆转录病毒的元素约占基因组的8%)。
研究人员发现内源性逆转录病毒引起的过度病毒拟态触发了z-DNA结合蛋白1 (ZBP1)依赖性的坏死,不可逆转地破坏了上皮屏障的稳态,最终促进了肠道炎症。在IBD患者中均可见到基因组不稳定、内源性逆转录病毒反应、ZBP1上调和坏死。
9.Science子刊:在免疫介导的肠道损伤中,T细胞产生的IFNγ杀死肠道干细胞
doi:10.1126/sciimmunol.aay8556
鉴于肠上皮每周都要更换,维持这种组织就需要由肠道干细胞驱动的快速自我更新。在包括同种异体骨髓移植在内的许多情况下,这种稳态都受到破坏。在同种异体骨髓移植(allogeneic bone marrow transplantation)后,同种异体T细胞经常以干扰素γ(IFNγ)依赖的方式攻击并杀死肠道细胞。
尽管肠道干细胞对肠道上皮维持很重要,但对免疫介导的损伤如何影响肠道干细胞及其所在的微环境的了解仍然有限。在一项新的研究中,来自美国纽约纪念斯隆凯特琳癌症中心和威尔康奈尔医学院等研究机构的研究人员发现肠道干细胞区室损伤是同种异体反应性的和自体反应性的肠道免疫病理学的共有特征,可减少肠道干细胞,并损害它们在T细胞介导的损伤模型中的恢复。相关研究结果近期发表在Science Immunology期刊上,论文标题为“T cell–derived interferon-γ programs stem cell death in immune-mediated intestinal damage”。

尽管成像结果显示在健康小鼠的肠道干细胞区室附近几乎没有T细胞,但是在同种异体骨髓移植后,浸润肠粘膜中的供者T细胞主要定位于肠道隐窝固有层中。利用离体肠上皮培养物进行的进一步建模表明一旦这种肠上皮培养物与活化的T细胞共培养后,肠道干细胞发生耗竭并损害了人类肠道类器官和小鼠肠道类器官的存活,而且对效应途径的筛选鉴定出干扰素-γ(IFNγ)是肠道干细胞区室遭受损伤的主要介体。IFNγ诱导JAK1和STAT1依赖性的毒性,从而启动促凋亡基因表达程序并导致肠道干细胞死亡。携带缺乏IFNγ的供者T细胞的骨髓移植、针对肠上皮特异性地缺乏IFNγ受体(IFNγR)的受者的骨髓移植,以及对JAK信号进行药物抑制,都会使得肠道干细胞区室免受损伤。此外,利用缺乏潘氏细胞(Paneth cell)的类器官、缺乏IFNγR的潘氏细胞和缺乏IFNγR的肠道干细胞以及纯化的肠道干细胞集落开展的体外实验表明对肠道干细胞的直接靶向并不依赖于潘氏细胞微环境的损伤。
10.EMBO J:移除基因NEDD4和NEDD4L导致肠道干细胞更快产生并加快肠癌发展
doi:10.15252/embj.2019102771
在一项新的研究中,来自英国弗朗西斯克里克研究所的研究人员发现携带着让两个特定的肿瘤抑制基因缺失或失活的突变的良性肠道肿瘤会更快地发展为癌性肿瘤。相关研究结果近期发表在EMBO Journal期刊上,论文标题为“NEDD4 and NEDD4L regulate Wnt signalling and intestinal stem cell priming by degrading LGR5 receptor”。
这项新的研究发现如果两个基因NEDD4和NEDD4L在肠道内的良性肿瘤中缺失,那么这种良性肿瘤会导致更多的肠道干细胞产生,因而会更快地发展为更可能发生癌变的肿瘤。
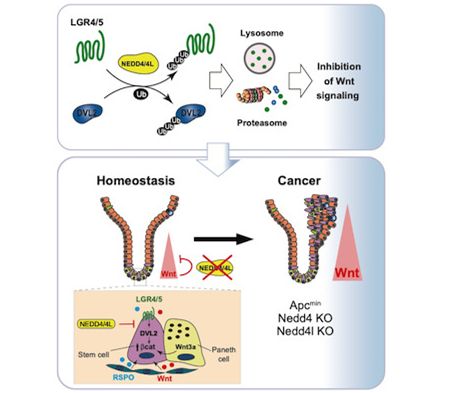
这些研究人员发现这两个基因编码的酶会抑制对细胞的生长很重要的Wnt途径。如果这两个基因发生缺失或失去功能,那么Wnt途径将变得更加活跃,这会刺激另一个称为LGR5的基因,从而产生更多的肠道干细胞。
当这些研究人员移除小鼠和反映体内肠道功能的肠道类器官中的NEDD4和NEDD4L基因时,他们发现当同时缺乏这两个基因或者缺乏这两个基因中的任何一个时,肠道干细胞就会更快地产生。当将这两个基因从良性肠道肿瘤中移除时,这些肿瘤产生更多的肠道干细胞,并且更快地发展为癌性肿瘤。
11.Gastroenterology:关键的肠道干细胞基因或能将膳食脂肪与结肠癌风险联系起来
doi:10.1053/j.gastro.2019.11.031
近日,一项刊登在国际杂志Gastroenterology上的研究报告中,来自罗格斯大学的科学家们通过研究发现,帮助肠道干细胞燃烧膳食脂肪的两个基因或在结肠癌发生过程中扮演关键角色。文章中,研究者阐明了小鼠机体细胞消耗脂肪的方式与基因调节肠道干细胞行为机制之间的关联。
研究者Michael Verzi教授表示,这一点非常重要,因为当肠道中存在太多膳食脂肪时,干细胞的数量就会增加,进而就会增加机体患结肠癌的易感性;人体每天都会失去数百万个肠道细胞,就好比我们失去皮肤细胞一样,肠道干细胞会经历不断地更新和肠道内壁的不断更新,但改变干细胞的功能或会引发结肠癌。
结直肠癌是美国人群中第三大常见的癌症类型,据美国癌症协会数据显示,每年大约有101,420人会被被诊断为结直肠癌患者。最近有研究表明,肠道干细胞的水平会在摄入高脂肪“西方”饮食的动物中增加,这或许就能够解释这种饮食方式增加癌症风险的原因。这项研究中,研究人员发现,HNF4A和HNF4G基因能互相协作来促进肠道内壁保持良好的功能,当这些基因被失活后小鼠就会失去肠道干细胞,这就证实了这两个基因的重要性,此外研究者还认为,这些基因能帮助干细胞燃烧脂肪从而为机体提供能量。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


