有糖尿病会让乳腺癌更凶?Commun Biol:外泌体是“隐形推手”,免疫细胞被“缴械”还帮肿瘤扩散
来源:生物谷原创 2025-09-01 14:04
这项研究不仅揭开了 “T2D 加剧乳腺癌” 的神秘面纱,更为未来治疗指明方向:比如通过抑制 T2D 外泌体中的关键 miRNA,或缓解免疫细胞的内质网应激,可能为这一高风险人群提供更精准的治疗选择。

患有 2 型糖尿病(T2D)的女性,不仅要应对血糖问题,还面临着乳腺癌的更高威胁——流行病学数据显示,T2D 女性患乳腺癌的风险比非糖尿病人群高 40%,相关死亡率更是高出 74%。
长期以来,医生们困惑于 “为何 T2D 会让乳腺癌更具侵袭性”,直到波士顿大学乔巴尼安与阿维迪西安医学院的研究团队在《Communications Biology》发表新研究,才揭开关键谜团:T2D 患者血液中的微小颗粒 “外泌体”,会悄悄重塑乳腺癌的肿瘤微环境(TME),一边让肿瘤细胞更擅长侵袭,一边 “缴械” 免疫细胞,使其失去抗癌能力。

论文通讯作者、波士顿大学希普利前列腺癌研究教授 Gerald Denis 博士指出:“这是首个直接证明 T2D 患者的外泌体,能抑制人类乳腺肿瘤内部免疫活性的研究。”
为了精准还原真实肿瘤环境,研究团队开发了一种创新的 “患者来源类器官(PDO)” 模型——他们从 3 名雌激素受体阳性乳腺癌患者的肿瘤组织中,通过胶原酶消化获得细胞簇,在基底膜提取物(BME)中培育出 3D 类器官,关键是,这个模型首次完整保留了肿瘤中原有的肿瘤浸润淋巴细胞(TILs),包括 T 细胞、B 细胞和巨噬细胞,解决了传统模型无法模拟肿瘤 - 免疫互动的痛点。
研究团队将类器官分为三组处理:不添加外泌体的空白组(UT-PDOs)、添加非糖尿病人群血浆外泌体的对照组(NDexo-PDOs),以及添加 T2D 患者血浆外泌体的实验组(T2Dexo-PDOs),外泌体剂量统一为 5000 颗粒 / 类器官细胞。这些外泌体来自两名严格筛选的 donors:一名 HbA1c 达 9.3% 的 T2D 患者(未用降糖药)和一名健康人,确保排除药物干扰。
单细胞 RNA 测序分析了 24599 个细胞后,研究人员发现 T2D 外泌体对肿瘤和免疫的影响远超预期。在肿瘤细胞层面,T2Dexo-PDOs 中的肿瘤细胞呈现出强烈的 “恶性特征”:上皮 - 间质转化(EMT)、癌症干细胞(CSC)相关通路上调 2.1 倍,NOTCH1、MMP14 等促侵袭基因表达增加,甚至在形态上出现更多 “出芽(budding)”——这是肿瘤转移能力强的典型表现。
进一步分析肿瘤亚型发现,T2D 外泌体导致 luminal-like 肿瘤细胞中的 LT1 簇扩张 1.5 倍,而 LT3 簇(增殖能力较弱的亚型)收缩 2.2 倍;LT1 簇恰好富集与 EMT、囊泡运输相关的基因,说明这些细胞更擅长突破组织屏障、扩散到其他器官。
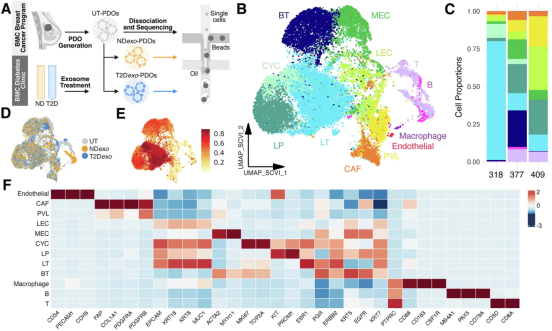
更致命的是对免疫细胞的 “破坏”。T2D 外泌体没有让免疫细胞 “战斗”,反而把它们推向了“功能瘫痪”:一种名为 ChopT 的免疫细胞(表达 DDIT3 蛋白,与内质网应激相关)数量激增 13.6 倍,这些细胞充满 “细胞压力”,无法分泌抗癌细胞因子,反而会抑制周围免疫活性;而具有先天抗癌能力的黏膜相关不变 T 细胞(MAIT 细胞)减少 6.5 倍,中央记忆 T 细胞(Tcm,负责长期免疫记忆)减少 5.3 倍。基因集富集分析(GSEA)显示,T2Dexo-PDOs 中抗炎的 IL-10 信号增强,而促炎的 TNF 信号减弱,整个免疫微环境从 “攻击模式” 切换为 “容忍模式”。
更意外的是,这些 T 细胞的功能障碍并非传统的 “免疫耗竭”(由 PD-1 等检查点分子导致),而是被 T2D 外泌体 “拐向” 了一条异常分化路径。伪时间分析显示,NDexo-PDOs 中的 T 细胞会正常分化为效应 T 细胞或记忆 T 细胞,而 T2Dexo-PDOs 中的 T 细胞却偏离轨道,走向以 “内质网应激” 为特征的功能衰竭——它们高表达 DDIT3、XBP1 等应激基因,低表达 IL7R、TBX21 等功能基因,这种 “非经典障碍” 也解释了为何免疫检查点抑制剂对 T2D 乳腺癌患者效果不佳:药物针对的是 “耗竭”,却管不了 “应激瘫痪”。
T2D 外泌体之所以能有这样的 “破坏力”,与其携带的特殊 “ cargo ” 有关。研究发现,这些外泌体中 miR-374a-5p、miR-93-5p 等 microRNA 含量显著升高,它们会特异性抑制 TIMP2、LACTB 等基质金属蛋白酶(MMP)的抑制剂,导致 MMP2、MMP14 等促侵袭蛋白 “失控激活”,帮助肿瘤细胞突破组织屏障;同时,外泌体还会激活 NOTCH、BMP 等信号通路,增强肿瘤细胞的干细胞特性,使其更难被治疗清除。
为了验证这些发现的临床意义,研究团队将 T2D 外泌体诱导的基因签名(如 TOP100 差异基因)应用到《癌症基因组图谱(TCGA)》和《乳腺癌国际联盟分子分类(METABRIC)》的大规模队列中,结果令人担忧:携带这种 “T2D 样签名” 的乳腺癌患者,总体生存率显著更低(TCGA 队列 HR=2.23,METABRIC 队列 HR=2.06),证明实验室发现的机制与真实临床结局密切相关。
Denis 博士强调:“乳腺癌治疗本就复杂,T2D 患者的预后更差,却一直缺乏针对性方案。我们的研究说明,T2D 不是简单的‘合并症’,而是通过外泌体重塑了肿瘤免疫微环境——免疫细胞不是‘不想打’,而是被‘逼到瘫痪’。” 目前美国有超过 1.2 亿人处于糖尿病或糖尿病前期,但现有肿瘤治疗标准几乎未考虑代谢状态的影响。这项研究不仅揭开了 “T2D 加剧乳腺癌” 的神秘面纱,更为未来治疗指明方向:比如通过抑制 T2D 外泌体中的关键 miRNA,或缓解免疫细胞的内质网应激,可能为这一高风险人群提供更精准的治疗选择。(生物谷Bioon.com)
参考文献:
Christina S. Ennis et al, Plasma exosomes from individuals with type 2 diabetes drive breast cancer aggression in patient-derived organoids, Communications Biology (2025). DOI: 10.1038/s42003-025-08663-y.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


