CRISPR基因编辑治疗8天后死亡,NEJM发布尸检结果,揭开患者死亡原因——AAV引起的先天免疫反应
来源:生物世界 2023-10-05 19:04
CRISPR基因编辑技术诞生至今仅10年时间,基因治疗也才20多年,CRISPR基因编辑和基因治疗在临床试验期间的任何死亡,都是对这些领域思考的契机。
CRISPR基因编辑技术的出现和应用,为遗传疾病的治疗带来了前所未有的希望,近几年,我们也看到了CRISPR基因编辑在罕见遗传病、癌症、心血管疾病中的临床进展,让许多面临罕见疾病和毁灭性疾病的家庭燃起希望。
2022年10月,一位名叫 Terry Horgan 的27岁杜氏肌营养不良症(DMD)患者在接受重组腺相关病毒9型(rAAV9)载体递送的CRISPR基因编辑治疗后不幸去世。

Terry Horgan和他的家人,图片来自Cure Rare Disease
2023年9月28日,麻省大学医学院和耶鲁大学的研究人员在《新英格兰医学杂志》(NEJM)上发表了题为:Death after High-Dose rAAV9 Gene Therapy in a Patient with Duchenne’s Muscular Dystrophy 的研究论文。
Terry Horgan 在接受治疗后第6天出现急性失代偿性心衰并持续心脏骤停,并在2天后死亡。研究团队对他的死亡原因进行了深入分析,尸检结果显示了严重的急性呼吸窘迫综合征(ARDS)伴弥漫性肺泡损伤,肝脏中转基因的表达极少,器官中没有AAV9抗体或效应T细胞反应的证据。这些结果表明,在接受大剂量rAAV递送的CRISPR基因编辑治疗的晚期DMD患者中,高剂量rAAV引起的强烈先天性免疫反应导致了急性呼吸窘迫综合征(ARDS),这也是学界首次报道基因治疗引发ARDS导致的患者死亡。

杜氏肌营养不良(DMD)
杜氏肌营养不良(DMD),是一种X染色体隐性遗传疾病,因此主要在男孩中发病。据统计,全球大约每3500名新生男婴中就有1人罹患此病。患者通常在3-5岁时开始发病,最早表现出进行性腿部肌无力,导致不便行走。通常在12岁时失去行走能力,在青春期开始出现心脏和呼吸无力,并导致严重并发症,通常在20岁-30岁因呼吸和心脏衰竭而死亡。
作为一种单基因疾病,杜氏肌营养不良症(DMD)是由X染色体上编码抗肌萎缩蛋白的Dystrophin基因突变所致,突变的Dystrophin基因无法产生足够或功能健全的抗肌萎缩蛋白,患者的肌肉组织逐渐被脂肪和纤维化组织取代。
定制CRISPR基因编辑疗法
本文的主人公 Terry Horgan 在5岁时被确诊患上了杜氏肌营养不良(DMD),此后,他开始每天使用地夫可特(Deflazacort)治疗,这是一种糖皮质激素,无法治愈DMD,只能在一定程度上缓解改善肌肉强度并减慢残疾的进程。
2017年,Terry的哥哥 Richard Horgan 创立了名为Cure Rare Disease(治愈罕见病)的非营利组织,旨在帮助Terry这样的罕见病患者。

Terry(左)和他的哥哥Richard(右)
2019年,Richard联合麻省大学、耶鲁大学的科学家,为弟弟Terry开发量身定制的CRISPR基因编辑疗法。
2022年8月,FDA批准了这项名为CRD-TMH-001的CRISPR基因编辑疗法的临床试验申请,用于治疗Terry的杜氏肌营养不良(DMD),这既是首款个性化CRISPR基因编辑疗法,也是首款获批临床的治疗DMD的CRISPR基因编辑疗法。
Dystrophin基因非常巨大,有多达79个外显子,不同的外显子上的突变都可能会导致DMD。由于基因太大,直接将正确编码的Dystrophin基因递送到细胞内的方式行不通。对于Terry来说,他是Dystrophin基因的1号外显子缺失突变,CRD-TMH-001疗法使用重组腺相关病毒9型(rAAV9)递送来自金黄色葡萄球菌的切割活性丧失的Cas9(dsaCas9)和转录激活蛋白VP64,来上调非肌肉全长抗肌萎缩蛋白亚型(Dp427c)的表达,从而稳定或逆转DMD的进展。
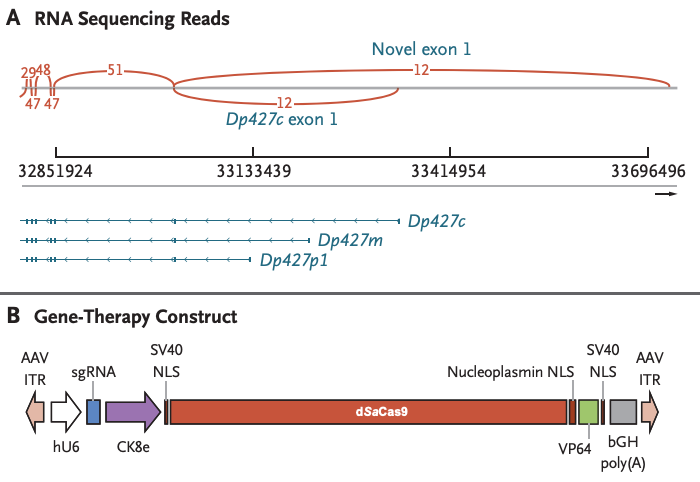
CRD-TMH-001疗法的设计
临床试验数据
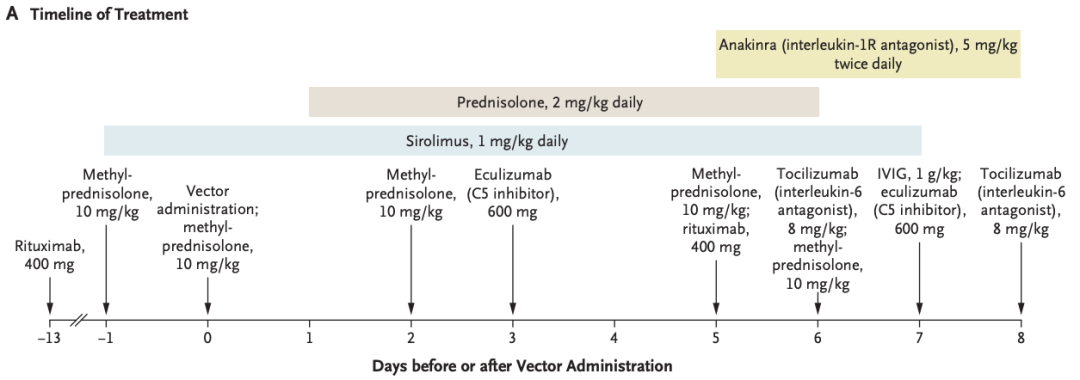
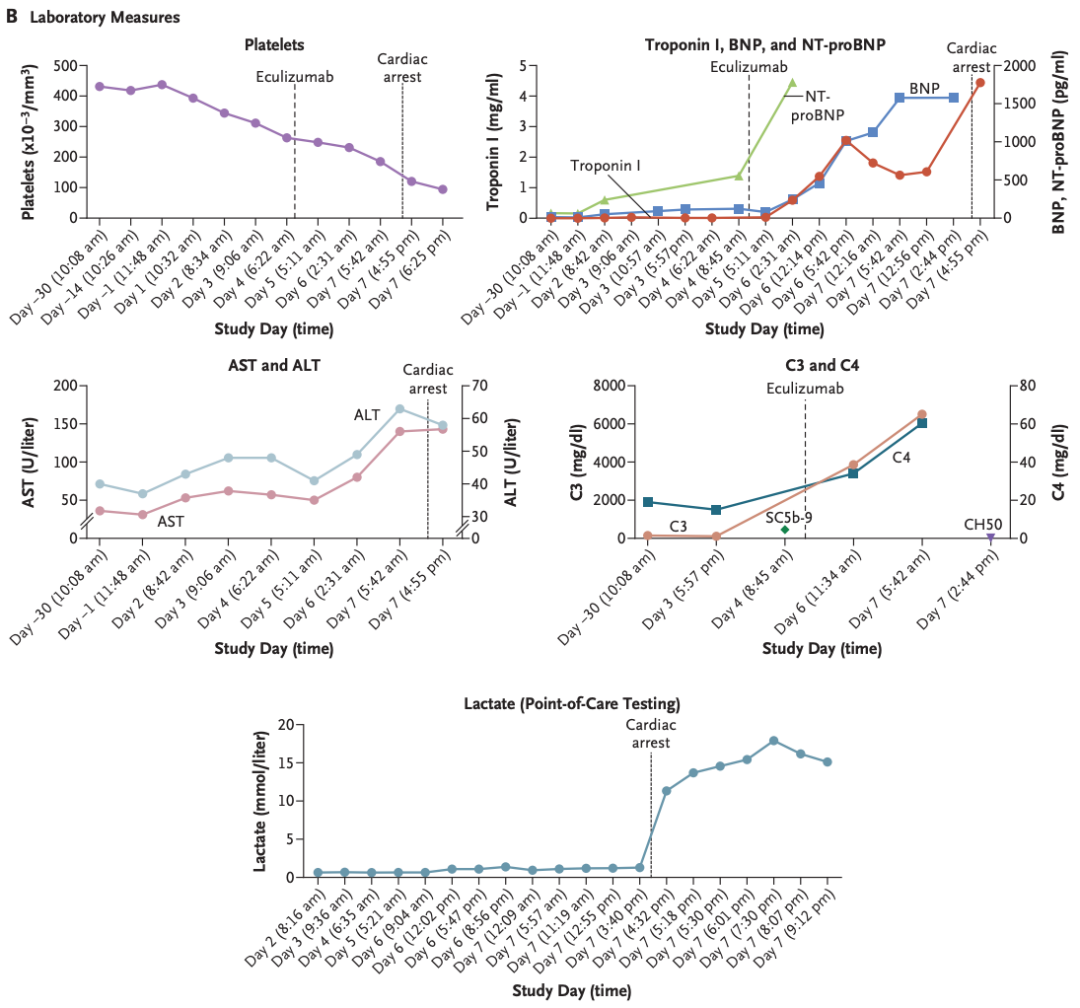
临床研究数据
在治疗期间,医生尝试了增加糖皮质激素剂量、依库珠单抗(抗C5抗体)、托珠单抗(抗IL-6R抗体)和阿那白滞素(IL-1R阻滞剂)。患者出现心肺骤停后,医生使用了ECMO呼吸机。但患者在注射治疗后第8天死于多器官衰竭和严重缺氧缺血性神经损伤,表现为昏迷和脑成像改变。
尸检结果分析
尸检结果显示,患者出现了严重急性呼吸窘迫综合征伴弥漫性肺泡损伤,转基因在肝脏中的表达极少。没有证据表明他存在AAV9抗体,也没有效应T细胞反应。这些发现表明,在接受高剂量AAV基因治疗的较大年龄的晚期DMD病例中,先天性免疫信号与毛细血管泄漏也是一种毒性形式。
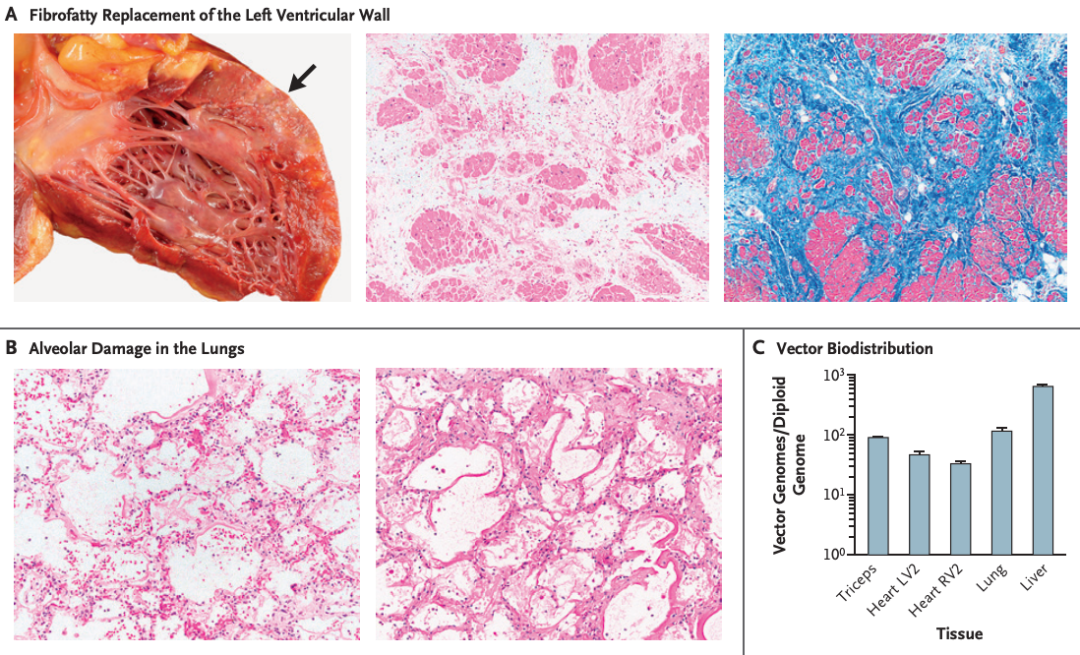
该患者此前接受的治疗剂量是1×10E14vg/kg,这与其他临床试验中的测试剂量相似,但导致该患者更高的病毒载体基因组负荷,研究团队认为这归因于患者的瘦肌肉质量较低。该研究还发现,该患者比那些在微型抗肌萎缩蛋白基因治疗临床试验中接受相似或更高AAV剂量的DMD患者发生了更严重的先天免疫反应。
基于这些发现,研究团队认为,在进行AAV基因治疗时,需要更多关于可能使人们容易产生严重先天免疫反应特征的数据,对于定制设计的AAV基因疗法,剂量确定仍将是一个挑战。
总的来说,这名27岁的晚期DMD患者在静脉注射1×1E14 vg/kg剂量的rAAV9-dSaCas9-VP6治疗后第6天发生了严重的心肺毒性作用。研究团队认为,该患者出现了细胞因子介导的毛细血管渗漏综合征,表现为治疗后第5天的心包积液和第6天的急性呼吸窘迫综合征(ARDS),并导致原来就有的右心室心力衰竭情况恶化。与接受rAAV基因治疗的其他一些DMD患者不同,该患者没有血栓性微血管病或对AAV衣壳或递送的转基因产物的适应性体液或细胞介导的免疫应答证据。
虽然血小板减少可能表明该患者发生了补体激活,但肺和心脏中没有补体沉积表明,补体介导的血栓性微血管病不是其死亡原因。急性呼吸窘迫综合征(ARDS)通常不与AAV基因治疗相关,其他接受相同剂量rAAV9载体基因治疗的患者也未出现这种毒性作用,这表明宿主因素和载体的固有特性均导致肺内的载体基因组水平意外升高,可能导致了这一结果。
由于该患者在接受治疗很快出现急性毒性作用,因此无法评估该疗法的安全性和有效性。虽然他的肝脏中存在微量的rAAV递送的转基因产物,但在心脏或骨骼肌中均未检测到,未观察到对dSaCas9或AAV9的效应T细胞应答,也未检测到抗AAV9中和抗体。另一个因素可能是该患者的瘦肌质量较低(仅45%),导致其每个肌肉细胞核所接受的rAAV载体剂量相对较高。
2021年,一名16岁的DMD患者在接受辉瑞公司开发的AAV基因疗法fordadistrogene movaparvovec(剂量为2×10E14 vg/kg)后6天死亡,该疗法使用rAAV9递送“迷你抗肌萎缩蛋白”,不涉及基因编辑。据分析,该患者的死亡与心肌中针对AAV病毒衣壳的先天免疫反应相关,该反应导致了心源性休克和心力衰竭。
总的来说,该论文揭示了 Terry Horgan 在接受定制的CRISPR基因编辑疗法后死亡的原因,他因为对高剂量的rAAV产生的先天免疫反应而死亡。27岁的他已经是DMD晚期晚期,这可能限制了其生理储备,降低了他在与基因疗法急性毒性反应相关的心肺应激下生存下来的能力。
在悲剧中前进
2022年10月14日,在 Terry Horgan 不幸去世后,Cure Rare Disease在公告中写道:Cure Rare Disease创始人兼首席执行官Richard Horgan的弟弟Terry Horgan不幸去世,他参与了一种新型CRISPR基因编辑疗法CRD-TMH-001的临床试验,目前还不清楚去世的原因。失去了Terry令人心碎,而他也将作为英雄被铭记,他是一位医学先驱,他的勇气和坚定的决心为人们更多地关注、资助和开发罕见病新疗法铺平了道路。
CRISPR基因编辑技术诞生至今仅10年时间,基因治疗也才20多年,CRISPR基因编辑和基因治疗在临床试验期间的任何死亡,都是对这些领域思考的契机。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


