清华大学陈春来/刘俊杰团队揭示CasX靶标搜索和切割过程的动态调控机制
来源:生物世界 2024-07-15 16:21
CasX独特的NTSB结构域在DNA解旋和R-loop形成中发挥了重要功能。这一动态模型深化了我们对CasX工作机制的理解,并为CasX以及其他Cas蛋白的优化和改造提出了新的思路和策略。
清华大学生命科学学院/北京生物结构前沿研究中心陈春来课题组与刘俊杰课题组合作,在 Nucleic Acids Research 期刊发表了题为:Conformational dynamics of CasX (Cas12e) in mediating DNA cleavage revealed by single-molecule FRET 的研究论文。
该论文细致表征了CasX从非特异性结合到找到靶点并完成切割的动态过程,揭示了其独特的机制。
利用供体(Cy3)标记的sgRNA和受体(Cy5)标记的DNA,研究者通过单分子FRET实验捕捉到CasX蛋白在切割过程中依次呈现的3种构象状态:R-loop起始状态、R-loop形成后非靶标链(NTS)切割状态和靶标链(TS)切割状态(图1)。此外,还定量分析了sgRNA与DNA的匹配度如何影响CasX在DNA上的稳定性和切割活性,为基于CasX的基因编辑和调控工具的设计提供了重要依据。DpbCasX和PlmCasX在切割特异性上的差异,源于它们在结合DNA及切割过程中的动力学差异;而两者在切割过程中FRET模式的不同,则归因于它们在DNA上切割位点的差异。
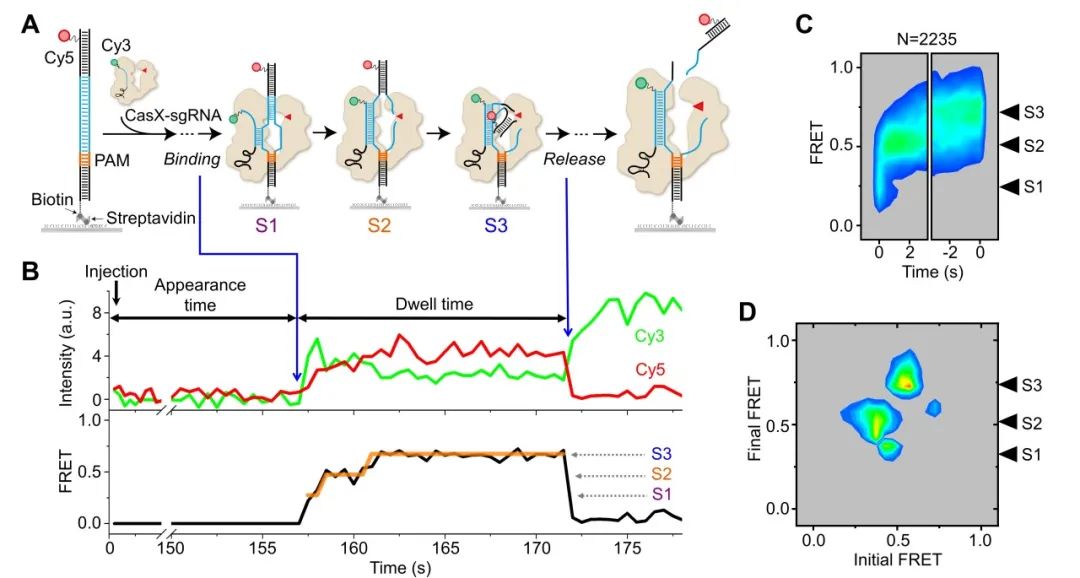
图1. DpbCasX结合及切割全匹配DNA的构象动态
在本文中,研究者还提出了“有效靶标搜索效率”这一新的概念,用以衡量Cas蛋白在接触靶标后的有效识别效率。数据显示,CasX的有效靶标搜索效率(仅10%)远低于Cas9和Cas12a(50%-80%)。这意味着,CasX需要尝试约10次才能成功识别靶标位点,细胞内复杂环境可能进一步降低其搜索效率,从而导致其在细胞内较低的编辑活性。这一发现为未来优化CasX以及其他Cas蛋白提供了新视角。
最后,研究者构建了CasX识别与切割DNA的动态模型(图2)。CasX在搜寻靶点时与DNA短暂非特异性结合(Nonspecific binding),在动态搜索过程中识别PAM序列(PAM recognition),开始形成R-loop结构(R-loop initiation),然而,相较于SpCas9、AsCas12a和LbCas12a, CasX在这一步的效率低5-8倍。识别PAM后,CasX依赖充足的PAM近端匹配驱动R-loop形成,并利用单一的RuvC结构域活性中心依次切割NTS和TS(R-loop formation and NTS cleavage,TS cleavage),最后释放切割产物(DNA fragment release)。CasX独特的NTSB结构域在DNA解旋和R-loop形成中发挥了重要功能。这一动态模型深化了我们对CasX工作机制的理解,并为CasX以及其他Cas蛋白的优化和改造提出了新的思路和策略。
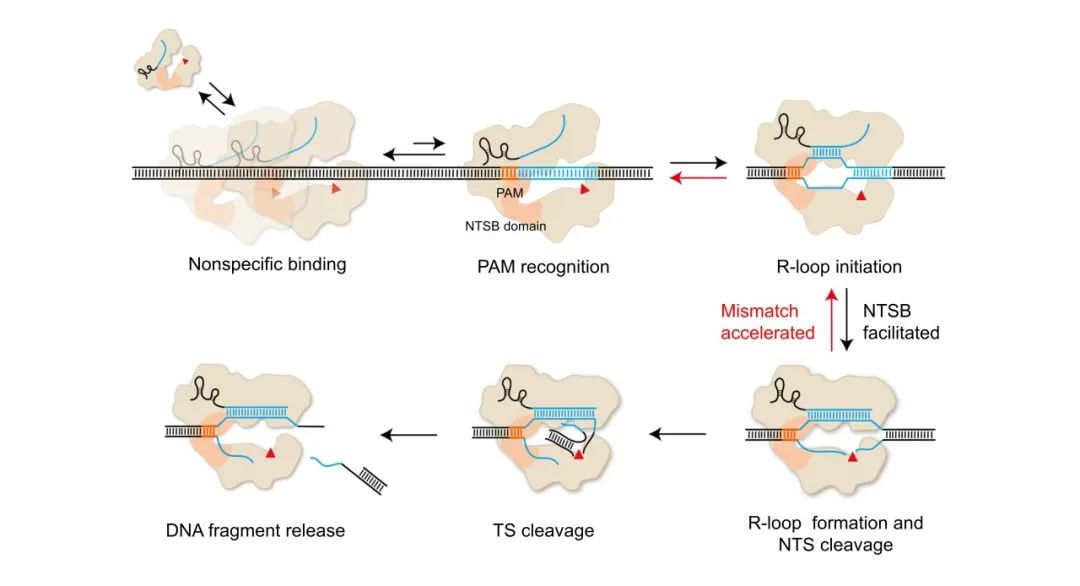
图2. CasX结合和切割DNA的动态模型
清华大学生命科学学院/北京生物结构前沿研究中心陈春来副教授和刘俊杰副教授为论文共同通讯作者;清华大学生命科学学院18级博士生邢文婧和18级博士生李丹苑为论文共同第一作者;生命科学学院高级工程师王文娟博士参与了本项目研究。本工作获得了国家自然科学基金委、国家重点研发计划、中国农业农村部、北京结构生物学高精尖创新中心、北京市生物结构前沿研究中心、清华-北大生命科学联合中心的经费支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


