Cell Mol Immunol丨吴励课题组揭示调控树突状细胞发育与生存的重要机制
来源:生物探索 2024-06-14 09:39
该研究首次报告了TRIM33通过促进Irf8表达以支持cDC1发育,同时通过抑制Bcl2l11在所有DC亚群及其前体中的表达,在维持DC的稳态中起到关键作用。
清华大学-北京大学生命联合中心吴励课题组近日在Cellular & Molecular Immunology期刊上在线发表了题为“TRIM33通过对Irf8与Bcl2l11转录的调控在树突状细胞的分化与稳态中发挥重要作用”(TRIM33 plays a critical role in regulating dendritic cell differentiation and homeostasis by modulating Irf8 and Bcl2l11 transcription)的研究论文。该研究首次报告了TRIM33通过促进Irf8表达以支持cDC1发育,同时通过抑制Bcl2l11在所有DC亚群及其前体中的表达,在维持DC的稳态中起到关键作用。

作为免疫系统中重要的调控细胞,树突状细胞(dendritic cells,DC)的稳态对于维持机体的先天和适应性免疫反应至关重要【1】。本项研究在课题组既往鉴定的调控DC发育分化的关键转录因子和表观遗传修饰因子【2-5】的基础上,确定了TRIM33作为调控DC分化和生存的又一新的调节因子的重要功能。
已有研究显示TRIM33通过转录及表观调控对红细胞、淋巴细胞、单核细胞和粒细胞系的谱系生成和功能具有显著影响【6-8】,但TRIM33在DC谱系中的作用仍不明确。此前研究显示TRIM33与转录因子PU.1,一个关键的DC命运调节因子之间具有相互作用【8】,进一步提示TRIM33可能参与了DC的谱系调控。
为了研究TRIM33在DC分化及稳态中的作用,作者首先对Trim33fl/fl Cre-ERT2小鼠进行了表型分析,观察到诱导全身性Trim33敲除后,经典1型DC(conventional type 1 DC, cDC1)和浆细胞样DC(plasmacytoid DC, pDC)明显缺失,cDC2数量则显著减少,同时DC前体的数量和DC生成潜能也严重受损。
为进一步解释这些发现的分子基础,作者检测了几种关键转录因子的表达,发现TRIM33缺失的DC前体中Irf8,一个调控cDC1分化的关键转录因子的表达显著下降。综合CUT&Tag、co-IP/MS等分子机制研究,作者证实TRIM33通过与Irf8基因体和增强子区域结合,通过影响CDK9和Ser2磷酸化RNA聚合酶II的招募直接调控Irf8的转录。这一发现解释了DC(尤其是cDC1)分化对TRIM33依赖性。此外,作者在DC前体中鉴定到了数百个TRIM33和PU.1的共结合位点,并证实TRIM33通过与促凋亡因子Bcl2l11(Bim)的一个增强子位点结合来抑制Bcl2l11(Bim)的转录,进而抑制DC及其前体的凋亡。同时进一步分析确定了在CD11c+条件性敲除的Trim33fl/fl Itgax-Cre小鼠中,大多数DC亚群的细胞数显著减少,这说明TRIM33的缺失导致了终末分化DC的生存缺陷。此外,研究还显示在DC前体中同时过表达irf8和敲低Bcl2l11可以恢复TRIM33缺失的DC前体产生cDC1的能力,但单一过表达Irf8或敲低Bcl2l11均不能产生此效果。因此,本研究鉴定了TRIM33在转录调控DC发育和维持其生存中的双重新功能,这些功能协同维持了DC的稳态。下图总结了TRIM33在DC谱系稳态中的关键作用。
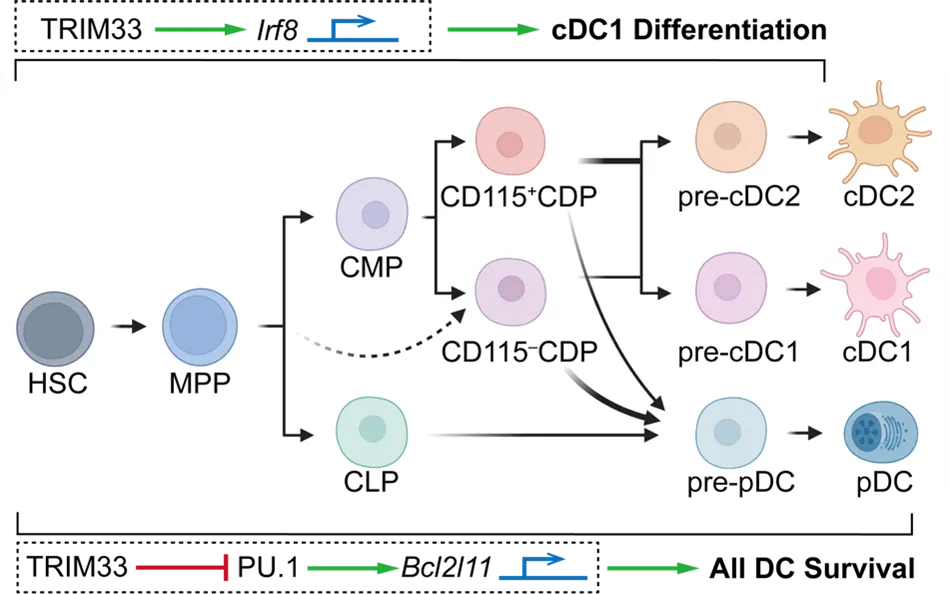
模式图(Credit: Cellular & Molecular Immunology)
有意思的是,近期Tiniakou I. et al.发表的一篇文章也描述了非常相似的发现【9】,是对本研究结果的很好佐证。本研究成果为深入了解DC发育和稳态的关键转录调节因子提供了新对知识,今后基于DC的免疫调节和治疗新策略的制定将会从这项研究中受益。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


