原来「人越老,觉越少」是真的!研究证实:随着年龄增长,分泌Hcrt神经元中的KCNQ2/3钾通道功能受损,导致睡眠不稳定和片段化
来源:生物谷原创 2024-12-08 09:29
通过这项研究,我们不仅揭开了老年人睡眠质量下降的神秘面纱,还为改善这一普遍问题提供了科学依据和潜在的解决方案。
每逢节假日或休息日,当年轻人与父母等长辈同住时,一场无形的“睡眠大战”便悄然上演:长辈们有的早上六七点钟就起床了,厨房里锅碗瓢盆的碰撞声、或是轻轻开门外出的脚步声,成了唤醒全家的第一道晨曲。而此时的年轻人通常还沉浸在梦乡之中。通常四、五个小时后,长辈们开始对那些能一觉睡到中午甚至下午的年轻人感到困惑不已:“他们怎么能这么能睡?”
其实,只要我们稍加观察就能发现,随着年龄的增长,人们的睡眠质量明显下降,从年轻时的“倒头就睡”变成了现在的“难以入眠”、“到点就起”,入睡困难、夜间频繁醒来以及浅睡眠增多等问题接踵而至。
这“睡觉越来越难”究竟是为什么呢?
为探究这一现象背后的神经生物学机制,斯坦福大学医学院的研究团队联合多家机构开展了一项深入研究,他们聚焦于大脑中负责调节觉醒状态的关键神经元——Hcrt(下丘脑分泌素/食欲素)神经元。研究发现:随着年龄增长,下丘脑分泌Hcrt神经元中的KCNQ2/3钾通道功能会受损,导致这些神经元过度兴奋,从而引起老年人常见的睡眠不稳定和片段化现象。

实验设计以及流程
本研究主要使用了年轻小鼠(2-3个月大)和老年小鼠(18个月以上),所有小鼠均为雄性。此外,还采用了基因工程小鼠模型,包括Hcrt-IRES-Cre敲入(Hcrt∷Cre)杂合子。
实验流程包括:
1. 病毒注射与电极植入:
年轻小鼠被分为两组,一组接受含有SaCas9和sgKcnq2/3的病毒混合物双侧立体定位注射到下丘脑区域,另一组则作为对照组接受不含sgRNA的控制病毒。所有小鼠均植入了EEG-EMG电极,以监测其连续8周内的睡眠/觉醒模式。
2. 行为学与生理监测:
在手术后至少两周恢复期之后,研究人员开始对小鼠进行连续的EEG-EMG信号记录,评估不同处理组之间睡眠结构的变化,特别是非快速眼动睡眠(NREM sleep)片段化的程度。
3. 组织切片与电生理记录:
从各组中选取部分小鼠制备300 μm厚的冠状脑切片,这些切片包含表达eYFP荧光标记的Hcrt神经元。并使用全细胞膜片钳技术记录这些神经元的静息膜电位(RMP)及放电特性,评估神经元的兴奋性。
4. 免疫组化与形态学分析:
对完成电生理记录的脑切片进行免疫染色,确认所记录神经元的身份及其表达特定标记物的情况,并通过共聚焦显微镜成像来观察并分析这些神经元的分布及形态特征。
年龄增长导致睡眠模式改变
与Hcrt神经元功能障碍相关
研究发现,与年轻小鼠相比,老年小鼠(18至22个月大)的睡眠模式更为碎片化,特别是在非快速眼动睡眠(NREM sleep)阶段。同时,老年小鼠的下丘脑分泌素/食欲素(Hcrt)神经元数量显著减少,大约减少了38%。这表明这些神经元在老化过程中非常脆弱。
通过光纤光度测定技术监测Hcrt神经元的活动,研究人员发现老年小鼠在睡眠期间Hcrt神经元的活动更加频繁。具体表现为Hcrt神经元的钙信号(GCaMP6f)在睡眠期间出现更多的瞬时活动,而这些活动与觉醒状态相关联。这表明老年小鼠的Hcrt神经元在睡眠期间更容易被激活,导致睡眠不稳定。
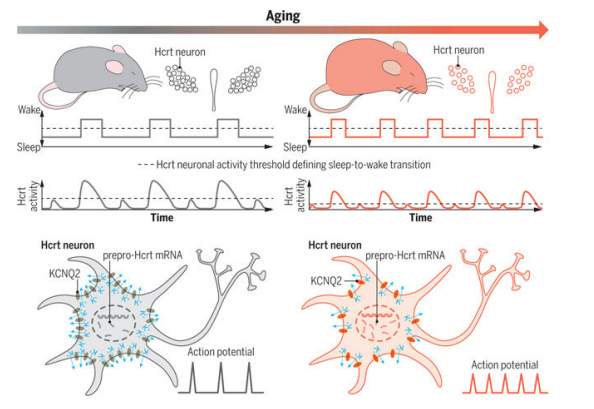
图1:在衰老过程中过度兴奋的Hcrt神经元导致睡眠不稳定
此外,利用光遗传学技术,研究人员发现老年小鼠的Hcrt神经元在光刺激下的反应比年轻小鼠更强,即老年小鼠在光刺激后从睡眠到觉醒的过渡时间更短,且觉醒持续时间更长。这进一步证实了老年Hcrt神经元的过度兴奋性。并且,电生理记录也显示,老年Hcrt神经元的静息膜电位(RMP)去极化,自发性放电活动增加。这意味着老年Hcrt神经元更容易被激活,从而导致睡眠片段化。
Hcrt神经元功能障碍的机制及未来干预方法
通过单核RNA测序和免疫组化分析,研究人员发现老年Hcrt神经元中KCNQ2/3通道的表达显著降低,尤其是KCNQ2通道。KCNQ2/3通道是维持神经元正常兴奋性的关键钾通道,其功能受损导致Hcrt神经元的内在兴奋性升高。
为明确Hcrt神经元功能障碍到底是怎么回事,研究人员使用CRISPR/SaCas9技术,在年轻小鼠的Hcrt神经元中特异性地破坏了Kcnq2/3基因。实验结果显示,这些年轻小鼠的NREM睡眠变得不稳定,与老年小鼠的睡眠模式相似。这说明,KCNQ2/3通道的功能受损确实是导致老年小鼠睡眠不稳定的主要原因之一。
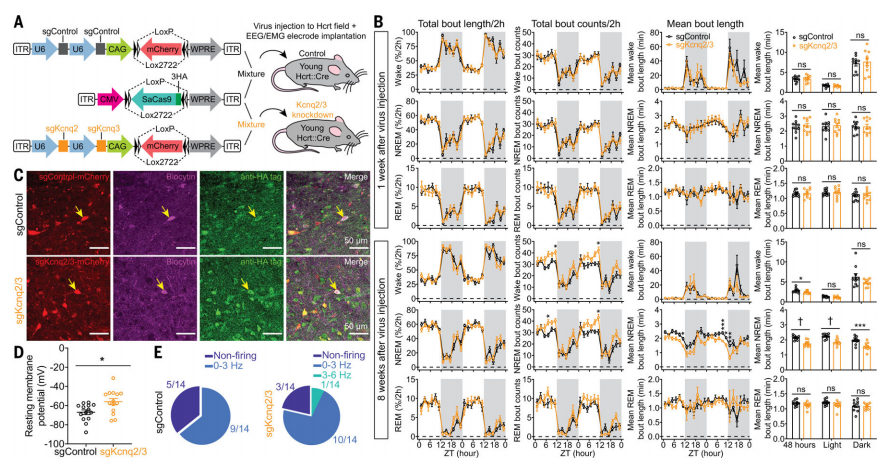
图2:使用CRISPR/SaCas 9特异性破坏Hcrt神经元中的Kcnq 2/3基因,导致幼鼠NREM睡眠片段化
紧接着,系统给药实验显示,使用KCNQ2/3通道的激活剂可以改善老年小鼠的睡眠质量,增加NREM睡眠的持续时间和稳定性。相反,KCNQ2/3通道的抑制剂则会增加觉醒时间,导致睡眠不稳定。
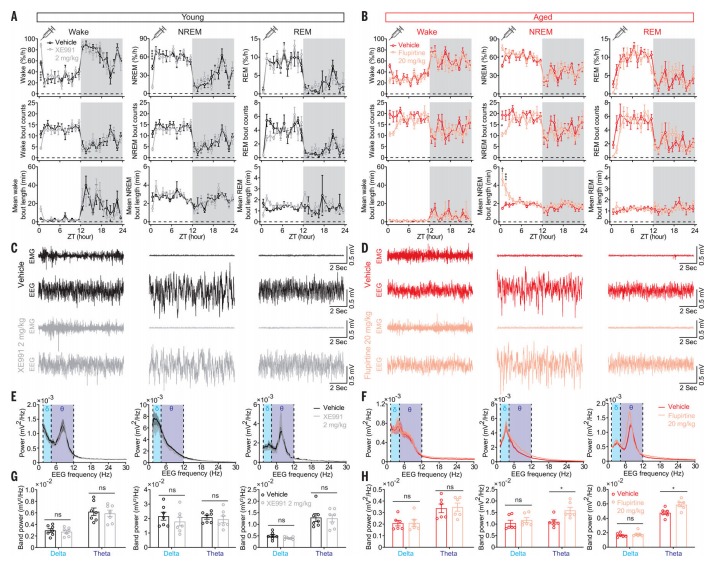
图3:用KCNQ 2/3配体对睡眠/觉醒状态的药理学操纵
基于研究结果,研究人员表示,KCNQ2/3通道在维持Hcrt神经元正常兴奋性方面起着重要作用。这些通道的功能受损会导致Hcrt神经元过度兴奋,进而影响睡眠质量。通过恢复KCNQ2/3通道的功能,或有助于改善老年人的睡眠。未来可以开发出针对KCNQ2/3通道的药物或基因疗法,以改善老年人的睡眠质量。
小结
通过这项研究,我们不仅揭开了老年人睡眠质量下降的神秘面纱,还为改善这一普遍问题提供了科学依据和潜在的解决方案。研究发现,随着年龄的增长,下丘脑分泌素/食欲素(Hcrt)神经元中的KCNQ2/3通道功能受损,导致这些神经元过度兴奋,从而引发睡眠不稳定和片段化现象。年轻小鼠经过基因编辑后表现出与老年小鼠相似的睡眠模式,进一步证实了KCNQ2/3通道在维持正常睡眠中的关键作用。
此外,研究还指出了可能的治疗靶点:通过恢复KCNQ2/3通道的功能,未来或许可以开发出有效的药物或基因疗法,帮助老年人重获高质量的睡眠~让我们拭目以待!
参考文献:
Li SB, Damonte VM, Chen C, et al. Hyperexcitable arousal circuits drive sleep instability during aging. Science. 2022;375(6583):eabh3021. doi:10.1126/science.abh3021
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


