磷酸化调控蛋白质结合机制研究取得进展
来源:精密测量院 2020-11-01 12:01
近日,中国科学院精密测量科学与技术创新研究院理论与计算化学组副研究员段谟杰等利用计算模拟方法及增强采样技术,揭示磷酸化修饰对固有无序KID结构及其与KIX蛋白结合过程的调控机制。磷酸化修饰是生物体内常见的一种翻译后修饰,在调控信号转导及细胞生长和凋亡等过程中发挥重要作用。较多磷酸化位点位于固有无序蛋白或无序蛋白区域上。这些蛋白的高度动态及伸展特性
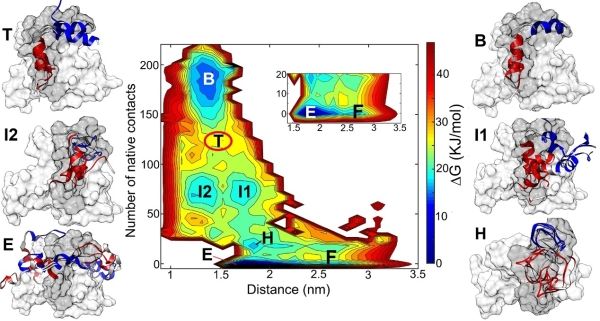
近日,中国科学院精密测量科学与技术创新研究院理论与计算化学组副研究员段谟杰等利用计算模拟方法及增强采样技术,揭示磷酸化修饰对固有无序KID结构及其与KIX蛋白结合过程的调控机制。
磷酸化修饰是生物体内常见的一种翻译后修饰,在调控信号转导及细胞生长和凋亡等过程中发挥重要作用。较多磷酸化位点位于固有无序蛋白或无序蛋白区域上。这些蛋白的高度动态及伸展特性使其较易被化学修饰。同时,诸如磷酸化等翻译后修饰能够改变和调控固有无序蛋白的结构和功能。作为一个模型体系,激酶诱导结构域KID在被磷酸化修饰之后,与转录共激活蛋白CBP上的KIX结构域结合并调控目标基因的表达。由于固有无序蛋白结构的高度动态性,因此,学界目前仍缺乏关于单个位点上磷酸化修饰如何能够高效调控KID与KIX结合的分子机制这一问题的合理解释。
分子动力学模拟借助理论计算手段,能够从原子水平上观测和获取蛋白质结构变化。为能够得到KID结构变化及与KIX结合过程,研究人员借助增强采样技术,得到KID-KIX结合过程的自由能变化。结果表明,磷酸化导致的蛋白质上电荷分布及静电相互作用变化并非是导致结合能力改变的直接原因。在磷酸化之后,在pKID蛋白上面形成由疏水残基组成的疏水团簇(HRC),其高度的疏水性驱使KID与KIX上的芳香族残基酪氨酸相互作用,并进一步引导pKID完成结合及折叠过程。该研究揭示KID与KIX结合的分子机制,为磷酸化修饰调控蛋白质的结构和功能提供新思路。 (生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


