Nat Cell Biol:利用铁死亡攻击迁移性的癌细胞,有望对抗侵袭性癌症
来源:生物谷原创 2024-07-17 10:17
在这项新的研究中,这些作者发现了这些迁移性转移细胞的一个致命弱点:这些具有间质特性的癌细胞在变形过程中会改变代谢,并在细胞膜中储存高浓度的多不饱和脂肪酸。
在一项新的研究中,来自埃尔朗根-纽伦堡大学、因斯布鲁克大学、麻省理工学院和维尔茨堡大学的研究人员如今离治疗侵袭性癌症这一宏伟目标又近了一大步。他们攻击迁移性癌细胞的方法是利用铁死亡(ferroptosis)——一种在2012年才被发现的细胞死亡机制。他们使用实验室物质进行的实验很有希望,但在此基础上使用药物之前,还需要进一步的临床前研究和临床研究。相关研究结果于2024年7月15日在线发表在Nature Cell Biology期刊上,论文标题为“Zeb1 mediates EMT/plasticity-associated ferroptosis sensitivity in cancer cells by regulating lipogenic enzyme expression and phospholipid composition”。

研究人员希望利用新机制对抗侵袭性癌症类型
化疗和免疫疗法的近期进展意味着癌症的治疗效果比以往任何时候都要好,而且近年来癌症患者的存活率也大幅提高。然而,对于诸如胰腺癌和某些类型的乳腺癌之类的侵袭性癌症,医生们仍然无能为力。
论文共同通讯作者、埃尔朗根-纽伦堡大学实验医学二系(分子肿瘤学)系主任 Thomas Brabletz 教授解释说,“这些肿瘤在很早的阶段就发生了转移,但却往往没有被发现。这使得它们特别具有挑战性和致命性。”
大约20年前,Brabletz发现肿瘤转移(metastasis)是由迁移的癌症干细胞引起的。要启动这一过程,单个上皮癌细胞(即紧凑型肿瘤的组成细胞)必须转变为具有间质特性的癌细胞。这样,具有间质特性的癌细胞可以迁移到全身各处,并通过变回上皮癌细胞而在不同部位形成转移瘤。Brabletz说,“我们将这种从一种细胞转变为另一种细胞的基本能力称为细胞可塑性(cell plasticity)。”
在这项新的研究中,这些作者发现了这些迁移性转移细胞的一个致命弱点:这些具有间质特性的癌细胞在变形过程中会改变代谢,并在细胞膜中储存高浓度的多不饱和脂肪酸。这使得细胞膜具有弹性,但也容易受到一种在2012年才被发现的至今仍未被完全理解的机制——铁死亡的影响。
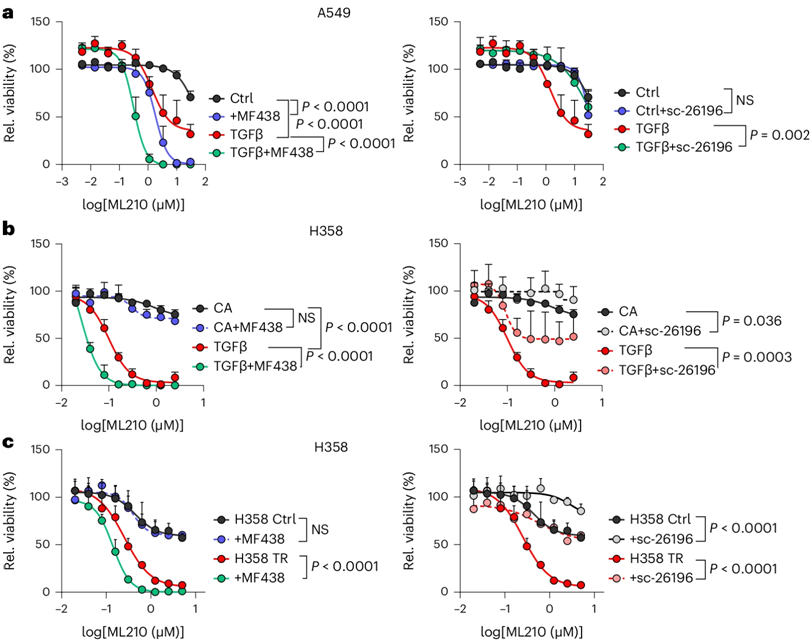
图片来自Nature Cell Biology, 2024, doi:10.1038/s41556-024-01464-1
Brabletz解释说,“铁死亡是由铁和氧自由基引发的一种非程序性细胞死亡,也与神经系统疾病和其他退行性疾病有关。脂肪酸会发生氧化,破坏细胞膜,最终摧毁整个细胞。”
这些作者非常希望这些发现能带来新的疗法,以对付具有侵袭性且转移潜力较大的癌症类型。在实验室实验中,他们成功地靶向了具有间质特性的肿瘤细胞,并利用铁死亡杀死了它们。
Brabletz 解释说,“我们目前正在研究利用药物操纵某些酶,使癌细胞更容易受到铁死亡的影响。”
由于原发性肿瘤的上皮细胞中多不饱和脂肪酸的含量较低,因此它们不会对铁死亡产生反应,从长远来看,他们计划将这种疗法与传统的化疗和免疫疗法结合起来。(生物谷Bioon.com)
参考资料:
Annemarie Schwab et al. Zeb1 mediates EMT/plasticity-associated ferroptosis sensitivity in cancer cells by regulating lipogenic enzyme expression and phospholipid composition. Nature Cell Biology, 2024, doi:10.1038/s41556-024-01464-1.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


