《自然·癌症》:中国医药大学团队找到“动摇”促癌蛋白KRAS的新疗法!
来源:奇点糕 2024-02-06 11:36
ADAM9i可提高所有PDAC细胞系对吉西他滨的敏感性,提高三倍以上,两者联合使用导致PDAC细胞的KRAS蛋白和下游通路下调,增强肿瘤细胞的凋亡。
近日,中国医药大学的佘玉萍、葉俊杰等人找到了KRAS蛋白的一个“稳定器”,蛋白质ADAM9。他们发现,ADAM9通过减少KRAS与另一种蛋白质的相互作用来稳定KRAS,阻碍KRAS被溶酶体降解。
小鼠实验中,ADAM9小分子抑制剂治疗能够减弱PDAC肿瘤生长,并且提高荷瘤小鼠对吉西他滨化疗疗法的敏感性[1]。
论文于近日发表在《自然·癌症》期刊上,为瓦解KRAS通路的PDAC治疗策略又提供了一种新的方向。

论文截图
之前的研究表明,野生型KRAS携带者比突变型KRAS携带者的预后更好。但是在这项研究中,研究团队利用三组独立的PDAC患者队列数据分析发现,无论患者携带野生型还是突变型KRAS,只要KRAS基因为高转录水平,都与其较差的总体生存率以及KRAS通路下游通路的激活相关,这个结论在来自中国医药大学的46名PDAC患者数据分析中得到验证。
对此,研究团队认为,不管它是野生型还是突变型,KRAS的蛋白活性直接与PDAC进展挂钩。
于是,他们识别出35种能够在PDAC进展中增强或维持KRAS活性的基因,这种作用与KRAS基因是否发生突变无关。其中,ADAM9是最为显著的候选基因之一,且蛋白质ADAM9调节KRAS活性的机制尚未被描述过。
研究团队进一步证实,ADAM9高表达水平与PDAC患者生存率低紧密相关(P=0.015),其水平在健康胰腺组织中较低,在癌前病变、PDAC组织中较高。不仅如此,他们发现,ADAM9与KRAS表达水平成正相关,且两者高表达对于PDAC患者死亡风险的提高具有协同效应,超过其各自单独的效应(风险比为2.15 vs 1.9 vs 1.83,P=0.0091)。
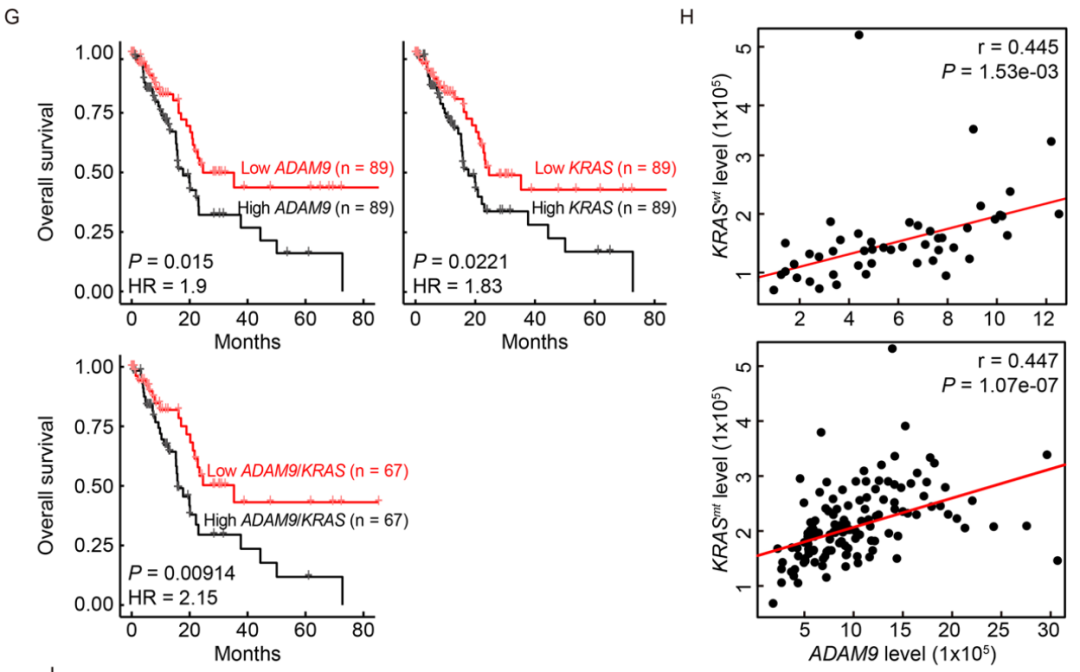
ADAM9和KRAS在PDAC中的临床相关性
体外实验结果显示,敲除ADAM9会导致PDAC细胞增殖减少一半以上(P<0.001)。PDAC小鼠模型实验结果显示,相比于ADAM9表达缺失,正常表达ADAM9的小鼠肿瘤大小增加近3倍(P<0.001);ADAM9缺陷会显著降低活化KRAS水平以及总体KRAS蛋白水平,且KRAS相关通路下调。
以上结果表明,ADAM9是PDAC进展过程中十分重要的KRAS活性调节剂。
接下来,研究团队揭示ADAM9调节KRAS活性的机制。
原来,ADAM9是KRAS的“稳定剂”,能够防止KRAS被降解,过表达ADAM9能够上调KRAS蛋白水平及其下游信号通路,而其缺陷对KRAS转录没有影响。
具体来看,PDAC细胞中,蛋白质PAI-1与KRAS结合后,会促进KRAS经溶酶体途径降解。ADAM9对KRAS曲线相救,通过抑制PAI-1的基因表达来减少KRAS的降解,维持KRAS的稳定性和持续激活。
27名PDAC原发肿瘤患者的免疫组化分析结果显示,PAI-1与KRAS表达呈负相关(r=−0.1874,P=0.0302 ),ADAM9与PAI-1表达呈负相关(r=−0.1635,P=0.0591),证实了ADAM9-PAI-1-KRAS信号通路在PDAC进展中存在。
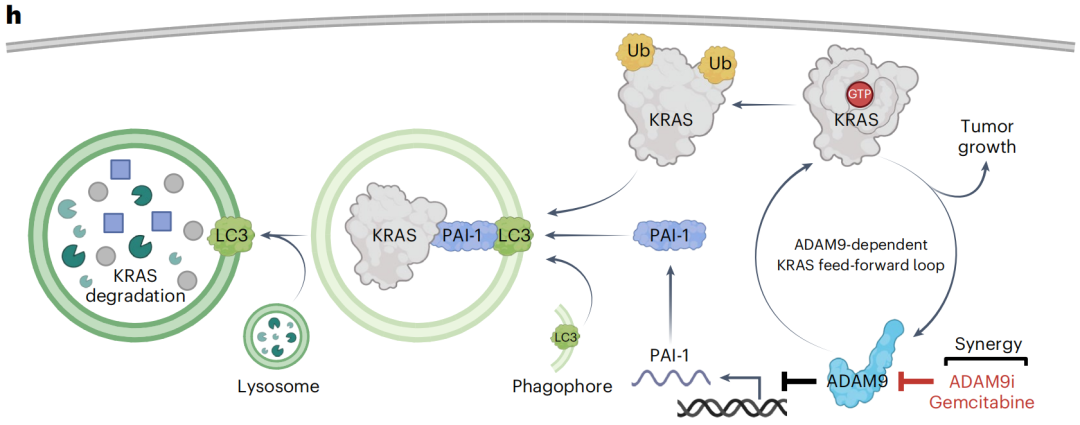
机制图
鉴于ADAM9催化域中存在可成药的口袋结构,研究团队从388000余种天然和化学合成药物数据库中进行筛选,找到了一种靶向ADAM9的小分子抑制剂(ADAM9i)。
体外实验证明,ADAM9i对ADAM9具有高度选择性和高亲和力。与敲除ADAM9基因的效果类似,ADAM9i能够有效抑制PDAC肿瘤生长,表达野生型KRAS或突变型KRAS的PDAC细胞对ADAM9i具有相似的药物敏感性,而正常细胞对其不敏感,毒性较低。
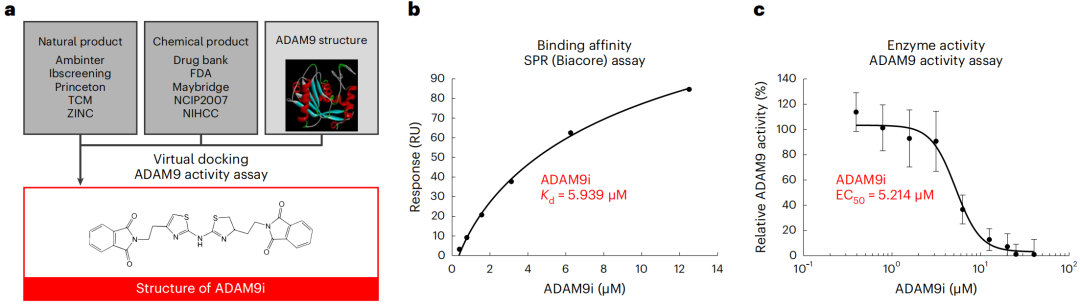
筛选得到ADAM9i
更重要的是,研究团队证明ADAM9i与化疗联用的重大意义。
大量研究表明,KRAS通路上调会导致PDAC患者对化疗产生耐药性。于是,研究团队评估ADAM9i与吉西他滨化疗联合治疗的效果。
体外实验结果显示,ADAM9i可提高所有PDAC细胞系对吉西他滨的敏感性,提高三倍以上,两者联合使用导致PDAC细胞的KRAS蛋白和下游通路下调,增强肿瘤细胞的凋亡。
PDAC小鼠实验结果显示,ADAM9i单药治疗8周可延缓小鼠肿瘤生长,ADAM9i与吉西他滨联合治疗效果更好,总生存率进一步提高。
研究团队还利用4名PDAC患者肿瘤组织衍生的细胞系体外培养和小鼠模型实验,评估ADAM9i的临床转化价值。
与上述结果相符,荷瘤小鼠采用ADAM9i单药治疗或与吉西他滨联用耐受性良好。ADAM9i单药治疗仅显示肿瘤细胞增殖减少,而与化疗联合治疗时才有细胞凋亡增强的效果。
ADAM9i与吉西他滨联合治疗8周后,70%荷瘤小鼠达到完全缓解,20%达到部分缓解,10%病情保持稳定;其ADAM9水平降低,伴随着PAI-1水平强烈上调和KRAS表达降低。
此外,研究团队利用体内外实验证实,ADAM9i+吉西他滨+白蛋白结合型紫杉醇(Abraxane)的组合具有更大的优势。
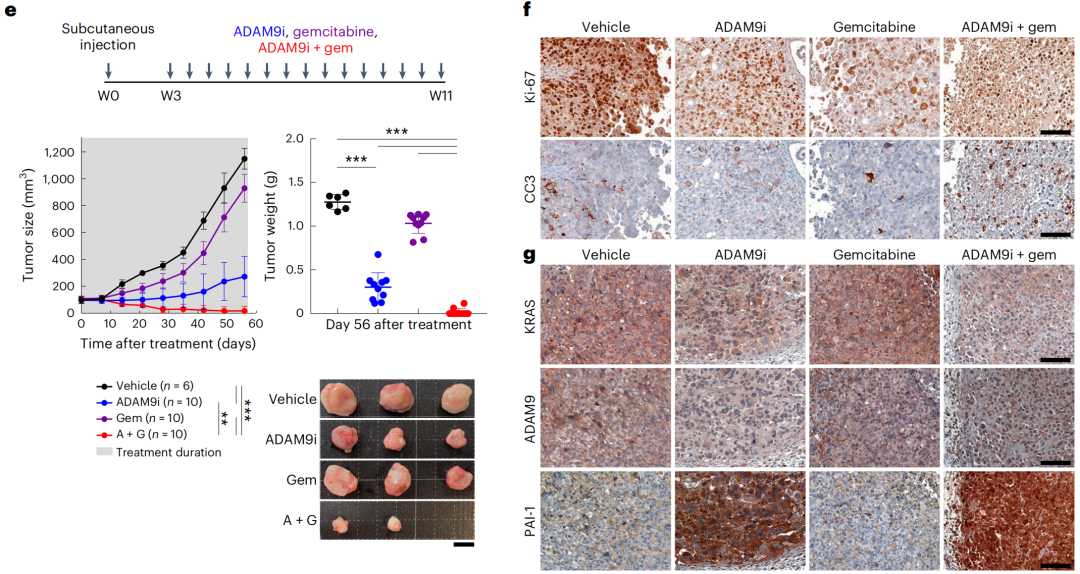
患者来源的小鼠模型中,ADAM9i+吉西他滨联合治疗效果
总之,这项研究揭示,通过抑制ADAM9可以破坏KRAS的活性,靶向ADAM9的小分子抑制剂能够增强现有的PDAC化疗方案,为PDAC化疗提供新的助力。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


