《自然·癌症》:三管齐下!41BB激动剂+CXCR1/2抑制剂+LAG3抑制剂或成胰腺癌治疗新策略
来源:奇点糕 2023-02-27 14:19
这项研究揭示了胰腺癌免疫抑制性微环境的细胞特征,并据此发现了一种潜在的胰腺癌免疫联合治疗创新方案,有望突破胰腺癌免疫治疗效果差、生存率低的瓶颈,期待该方案能够尽快进入临床验证阶段。
胰腺癌由于其极差的生存预后素有“癌王”之称,患者5年生存率仅为10%左右[1],造成这种现象的主要原因之一,是临床治疗选择有限、且整体效果较差,尤其是对晚期胰腺癌,目前系统性药物治疗主要为FOLFIRINOX方案及吉西他滨为基础的化疗[2],但化疗效果非常有限,仍需开发新的治疗方式。
基于免疫检查点抑制剂的免疫疗法,是一种新兴的肿瘤治疗手段,已改变大多数实体瘤治疗的格局,但在胰腺癌中却收效甚微,例如,PD-1抗体联合CTLA-4抗体治疗转移性胰腺癌的客观缓解率仅为3.1%[3]。
胰腺癌对免疫检查点抑制剂无反应的主要原因,是肿瘤微环境为免疫抑制性,特征为髓系细胞大量浸润及CD8+T细胞功能障碍[4,5]。因此,进一步明确胰腺癌微环境的免疫抑制特征并针对性解决,对于改善免疫检查点抑制剂的治疗效果至关重要。
近日,由美国MD安德森癌症中心Ronald A. DePinho教授领衔的研究团队在Nature Cancer发表了一项重要研究成果。研究发现,胰腺癌微环境中存在明显的髓系细胞浸润和T细胞功能失调,针对这种免疫抑制表型,使用41BB激动剂及CXCR1/2抑制剂联合免疫检查点LAG3抑制剂,实现持续性的肿瘤缓解[6],这或许可以成为胰腺癌治疗的新策略。

文章封面截图
为明确胰腺癌微环境特征,Ronald A团队构建了基于基因工程的胰腺癌自发成瘤鼠模型并对其进行生物发光及影像学检测(图1)。随后,他们通过CyToF法对肿瘤浸润性免疫细胞进行了检测,使用标准化决策树分析(SPADE)对微环境中的免疫细胞亚群进行了归类。
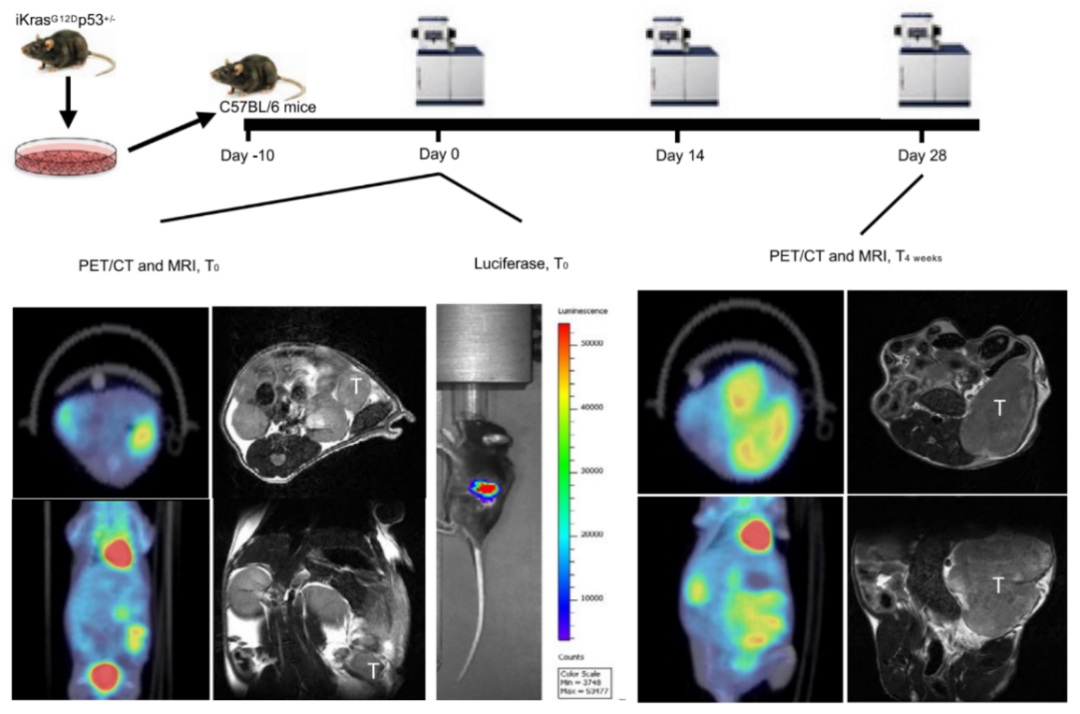
图1. 胰腺癌自发成瘤鼠模型的建立
Ronald A团队发现,这种自发瘤模型与人胰腺癌组织中的免疫细胞成分及比例相近。他们使用多重免疫组化分析发现,小鼠胰腺癌组织中CD8+T细胞的比例和分布与人胰腺癌组织相近(图2a),且CD33+CD11b+CD66b+的中性粒细胞和CD33+CD14b+CD68b+的肿瘤相关巨噬细胞的分布和比例在两种组织中也很相似(图2b),这表明构建的小鼠模型具有较高的人类模型模拟度和保真度。
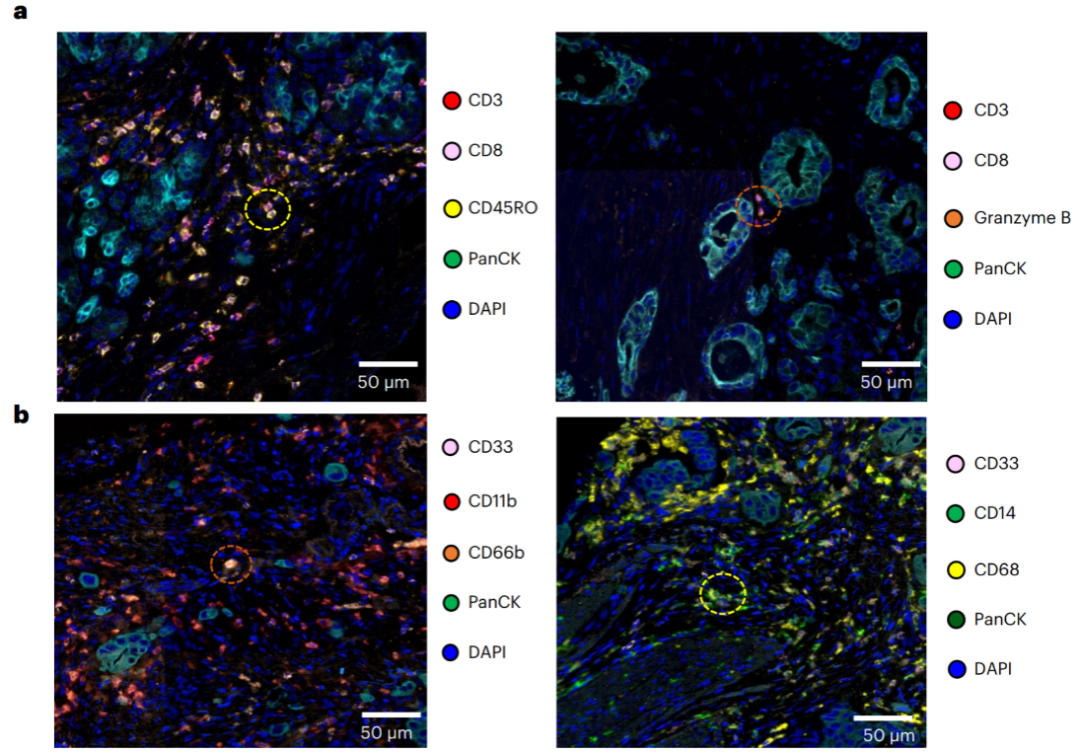
图2. 小鼠模型和人胰腺癌组织中免疫细胞分布
Ronald A团队通过SPADE分析发现,骨髓来源免疫抑制细胞(MDSCs)和巨噬细胞为胰腺癌微环境中的主要免疫细胞亚群(图3),此外,他们还检测了肿瘤内记忆性和细胞毒性CD8+T细胞,发现这些T细胞会出现耗竭或者功能失调的情况。
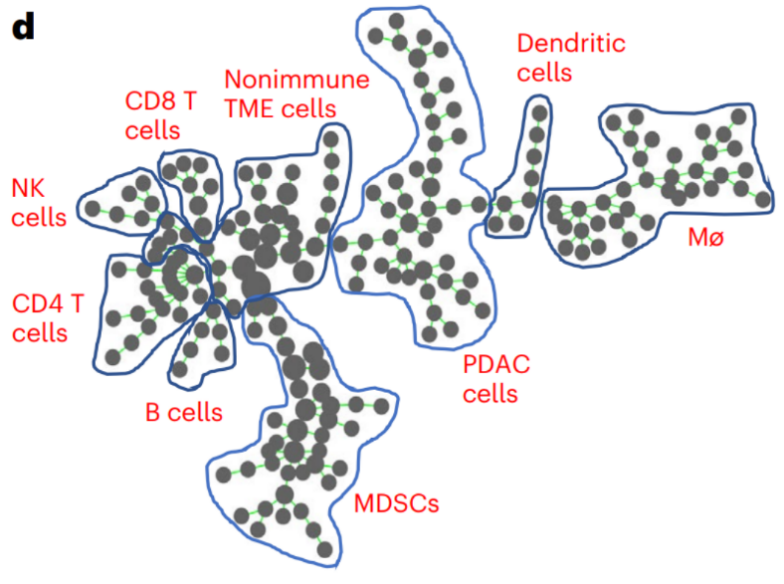
图3. 胰腺癌组织中髓系细胞为主要亚群
为进一步明确肿瘤内T细胞的特征,Ronald A团队使用无监督聚类法将T细胞分为6簇:中央记忆性CD4+T细胞、Treg细胞、中央记忆性CD8+T细胞、细胞毒性CD8+T细胞、耗竭性CD8+T细胞和高度复制的CD8+T细胞。
Ronald A团队发现,激活性免疫检查点41BB和Ox40、抑制性免疫检查点LAG3、PD-1、CTLA-4和TIM3在耗竭性CD8+T细胞中表达,而在其他类型的CD8+T细胞中不表达(图4)。
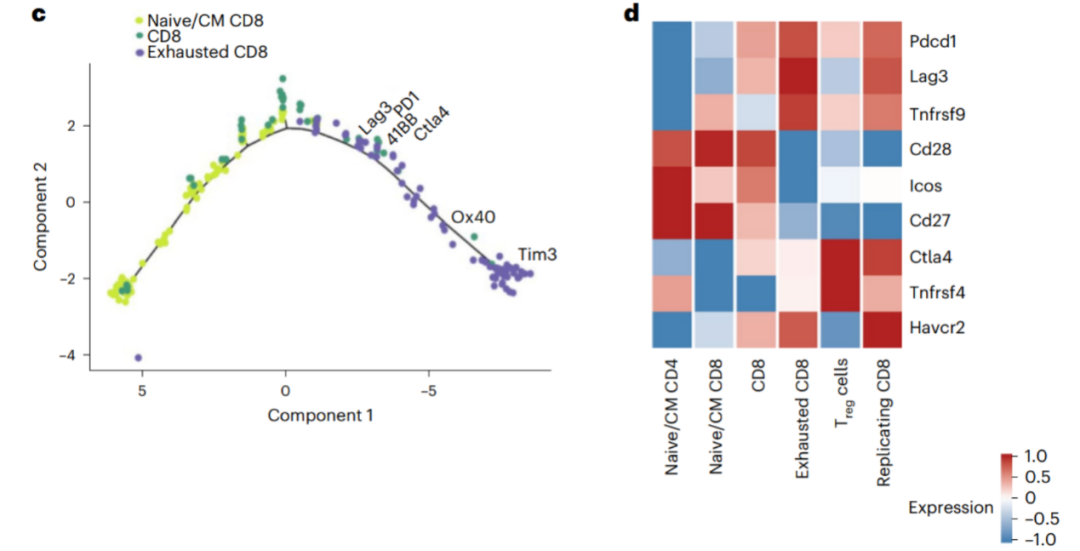
图4. 耗竭性CD8+T细胞中的基因表达
基于以上结果,Ronald A团队分别使用了41BB、Ox40靶点激动剂,以及LAG3、PD-1、CTLA-4和TIM3位点的抑制剂,对胰腺癌小鼠进行治疗,结果显示,相比于其他组,经41BB激动剂及LAG3抑制剂治疗的小鼠出现明显的肿瘤抑制及生存改善(图5a,b),且两者联合后可进一步抑制肿瘤生长并改善小鼠生存(图5c,d),但肿瘤仍然无法完全消除,小鼠仍然会因肿瘤死亡(图5d)。
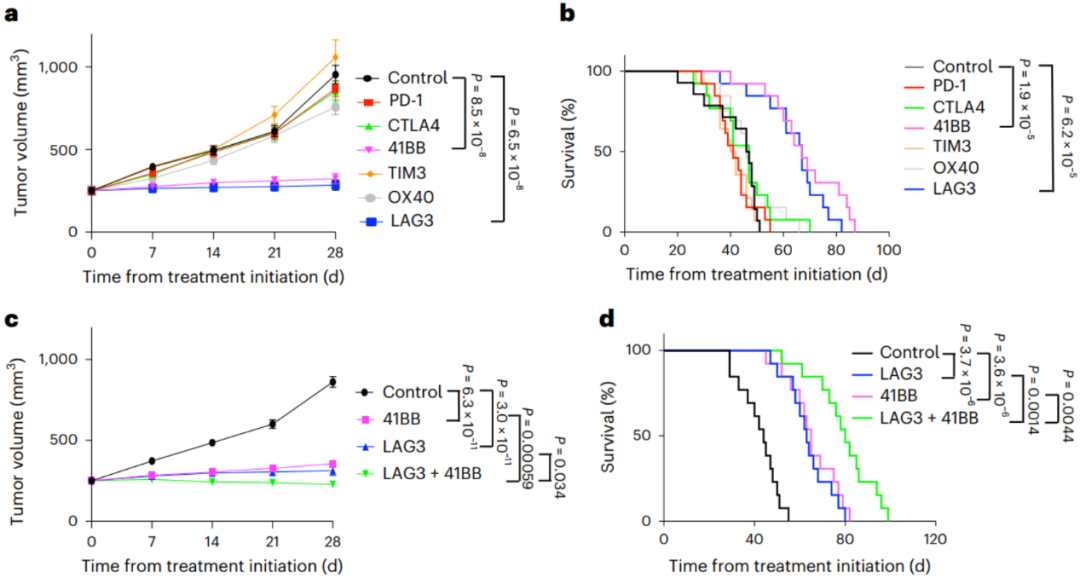
图5. LAG3抑制剂及41BB激动剂的治疗效果
Ronald A团队发现,与对照组及无效治疗组(PD-1及CTLA-4抑制剂)相比,41BB激动剂及LAG3抑制剂显著改善了T细胞的耗竭表型,且肿瘤内T细胞的信号转导、细胞因子产生、增殖和细胞溶解活性均上调,还增加了T细胞的克隆性和多样性,减少了免疫抑制性的髓系细胞,增加抗原呈递从而促进抗肿瘤免疫反应。
然而,41BB激动剂及LAG3抑制剂联合后仍不能完全消除肿瘤,这表明还需靶向其他免疫抑制机制,来进一步提升疗效。研究者重新注意到了胰腺癌组织中大量存在的MDSCs,发现粒细胞或中性粒细胞MDSCs中存在CXCR2的过度表达,而CXCR2在将MDSCs招募到肿瘤组织中起到了关键作用。
因此,研究者们将目标锁定为CXCR2,探索了在研CXCR1/2抑制剂SX-682的效果:经SX-682治疗后,肿瘤内MDSCs浸润减少(图6),CD8+T细胞浸润增加,树突状细胞浸润轻度增加,肿瘤相关巨噬细胞浸润无显著改变,这表明CXCR1/2信号在髓系细胞介导的胰腺癌免疫抑制中发挥重要作用,而SX-682或可联合LAG3抑制剂及41BB激动剂,发挥更强大的抗肿瘤效果。
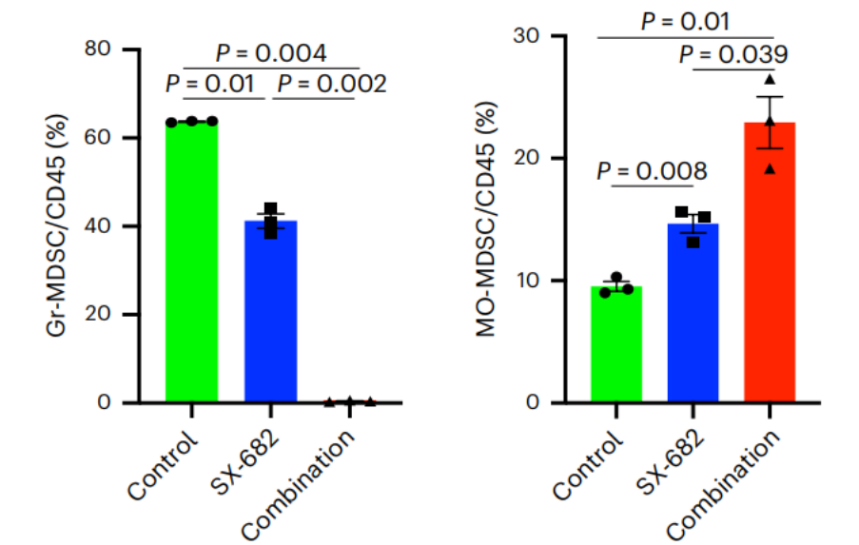
图6. SX-682对MDSCs浸润的影响
随后研究者们使用了“41BB激动剂+LAG3抑制剂+SX-682”的联合方案,对胰腺癌小鼠进行治疗,发现这种联合方案可使得大部分小鼠肿瘤完全消退,且90%小鼠在停止治疗18个月后仍然存活(图7),这表明这套“组合拳”或可产生持久性的肿瘤消退作用。
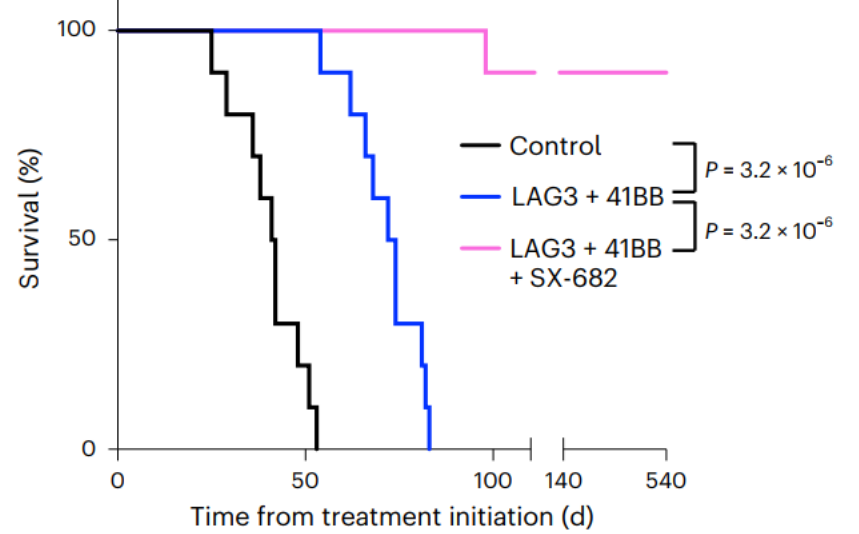
图7. 41BB激动剂、LAG3抑制剂、SX-682联合治疗胰腺癌的效果
综上所述,这项研究揭示了胰腺癌免疫抑制性微环境的细胞特征,并据此发现了一种潜在的胰腺癌免疫联合治疗创新方案,有望突破胰腺癌免疫治疗效果差、生存率低的瓶颈,期待该方案能够尽快进入临床验证阶段。
参考文献:
[1] Grossberg AJ, Chu LC, Deig CR, et al. Multidisciplinary standards of care and recent progress in pancreatic ductal adenocarcinoma. CA Cancer J Clin. 2020 Sep;70(5):375-403. doi: 10.3322/caac.21626.
[2] Tempero MA, Malafa MP, Al-Hawary M, et al. Pancreatic Adenocarcinoma, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2021 Apr 1;19(4):439-457. doi: 10.6004/jnccn.2021.0017.
[3] O'Reilly EM, Oh DY, Dhani N, et al. Durvalumab With or Without Tremelimumab for Patients With Metastatic Pancreatic Ductal Adenocarcinoma: A Phase 2 Randomized Clinical Trial. JAMA Oncol. 2019 Oct 1;5(10):1431-1438. doi: 10.1001/jamaoncol.2019.1588.
[4] Ying H, Dey P, Yao W, et al. Genetics and biology of pancreatic ductal adenocarcinoma. Genes Dev. 2016 Feb 15;30(4):355-85. doi: 10.1101/gad.275776.115.
[5] Bear AS, Vonderheide RH, O'Hara MH. Challenges and Opportunities for Pancreatic Cancer Immunotherapy. Cancer Cell. 2020 Dec 14;38(6):788-802. doi: 10.1016/j.ccell.2020.08.004.
[6] Gulhati P, Schalck A, Jiang S, et al. Targeting T cell checkpoints 41BB and LAG3 and myeloid cell CXCR1/CXCR2 results in antitumor immunity and durable response in pancreatic cancer. Nat Cancer. 2022 Dec 30. doi: 10.1038/s43018-022-00500-z.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


