罕见肥胖症新药!强效首创MC4R激动剂Imcivree治疗MC4R通路缺陷肥胖疗效强劲!
来源:本站原创 2021-01-31 22:36
Imcivree已被批准,治疗2种罕见肥胖症。

2021年01月31日/生物谷BIOON/--Rhythm Pharmaceuticals是一家专注于开发和商业化治疗罕见肥胖遗传性疾病的生物制药公司。近日,该公司公布了来自2期篮子研究多个队列的新的阳性概念验证数据。该试验正在评估Imcivree(setmelanotide)治疗因MC4R通路的基因变异导致的罕见严重肥胖症患者。
Imcivree是一种黑皮质素4(MC4)受体激动剂,这是一种首创(first-in-class)的精准药物,旨在直接解决由MC4受体通路中的基因缺陷引起的肥胖症的根本原因。2020年11月,Imcivree获得美国FDA批准,用于年龄≥6岁的罕见肥胖症儿童和成人患者的长期体重管理,具体为:经基因检测证实是由前阿片黑素细胞皮质激素(POMC)、前蛋白转化酶枯草杆菌蛋白酶/kexin1型(PCSK1)或瘦素受体(LEPR)缺陷引起的肥胖症。

肥胖症(图片来源:ddg-gastro.be)
此次公布的2期篮子研究涉及3种不同的罕见肥胖遗传病:(1)由于POMC、PCSK1、LEPR基因(HET)的2个等位基因之一的遗传变异而导致的HET肥胖;(2)由SRC1缺陷症导致的肥胖(SRC1);(3)由SH2B1缺陷症(SH2B1)导致的肥胖。5个队列中,截止到2020年12月17日,65例重度肥胖症患者有资格进行分析。研究的主要终点是:每个亚组中三个月内体重下降至少5%的患者比例。
(1)HET肥胖症(POMC、LEPR、PCSK1)亮点:总体而言,35例患者中有12例(34.3%)达到了主要终点。这项全面分析包括6例提前退出的患者。所有35例患者的平均体重比基线下降了-3.7%,包括临床有反应者和无反应者;在达到主要终点的12例患者中(应答组),体重较基线平均减少-10.1%。
根据美国医学遗传学学会(ACMG)指南,根据基因变异分类,将HET肥胖患者分为三个预先指定的队列:8例具有致病性或可能致病性变体的患者中有4例(50.0%)体重减轻超过5%;8例患者中有4例(50.0%)有PCSK1基因的N221D变体,体重减轻超过5%;19例患者中有4例(21.1%)具有未知意义的变异(VOUS),体重减轻超过5%。
(2)来自SRC1和SH2B1队列的数据基于对完成12周治疗的患者的中期分析。这项分析不包括15例因COVID相关问题、不良事件或失去随访而提前退出的患者。还未包括12例仍在进行治疗但尚未达到12周治疗的患者的数据。
SRC1缺陷症导致的肥胖亮点包括:13例患者中有4例(30.8%)达到主要终点;所有13例患者的体重均比基线下降了-3.7%,包括临床有反应者和无反应者;在达到主要终点的4例患者中(应答组),体重较基线平均下降了-8.4%。
SH2B1缺陷症导致的肥胖亮点包括:17例患者中有9例(52.9%)在治疗12周后体重减轻超过5%;所有17例患者的平均体重比基线下降了-3.9%,其中包括临床有反应者和无反应者;在达到主要终点的9例患者中(应答组),体重较基线平均下降了-7.1%。
与先前的临床经验一致,在每一种罕见的肥胖遗传病中,setmelanotide的耐受性都很好。最常见的治疗期间出现的不良事件(TEAE)包括轻度注射部位反应、色素沉着、恶心和呕吐,这些都发生在治疗早期。没有发生与setmelanotide治疗相关的严重不良事件。
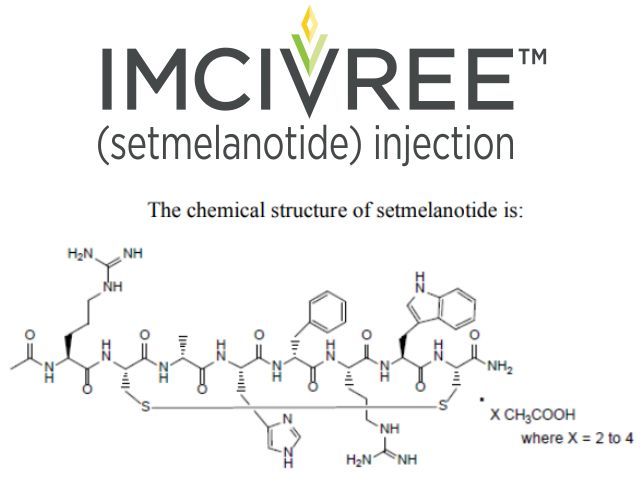
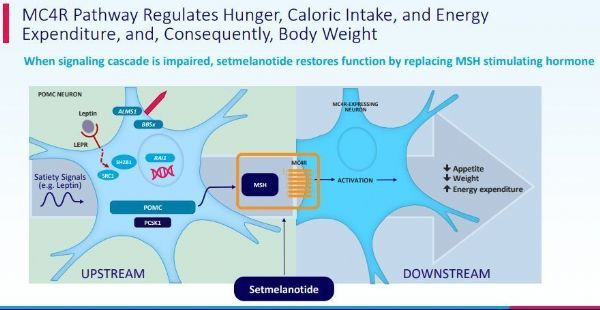
Imcivree的活性药物成分为setmelanotide,这是一款首创、寡肽类MC4R激动剂,开发用于治疗罕见肥胖遗传性疾病。MC4R是机体独立调节能量消耗和食欲的关键生物学通路的一部分。基因变异可能会损害MC4R通路的功能,而这可能会导致极度饥饿(食欲过盛)和早发性严重肥胖。目前,setmelanotide正被开发作为一种靶向疗法,恢复受损MC4R通路的功能,重新建立罕见肥胖遗传性疾病患者的能量消耗和食欲控制,减少饥饿感、降低体重。在Imcivree批准前,还没有药物疗法来治疗这些罕见肥胖遗传性疾病。
2020年11月底,Imcivree获得美国FDA批准,用于年龄≥6岁的罕见肥胖症儿童和成人患者的长期体重管理,具体为:经基因检测证实是由前阿片黑素细胞皮质激素(POMC)、前蛋白转化酶枯草杆菌蛋白酶/kexin1型(PCSK1)或瘦素受体(LEPR)缺陷引起的肥胖症。
通过这项批准,Imcivree成为有史以来第一个FDA批准的治疗这些罕见遗传性肥胖症的药物。目前,Imcivree也正在接受欧洲药品管理局(EMA)的加速评估。在美国和欧盟,setmelanotide均被授予了治疗POMC和LEPR缺陷型肥胖症的孤儿药资格(ODD),同时分别被授予了突破性药物资格(BTD)和优先药物资格(PRIME)。
值得一提的是,在批准Imcivree的同时,FDA还颁发给Rhythm一张罕见儿科疾病优先审查凭证(PRV),以奖励该公司做出的突出贡献。这张PRV可用于加速批准未来的申请,也可出售给第三方。最近的2笔PRV交易,售价在9000万美元左右。
由POMC、PCSK1或LEPR缺陷导致肥胖的患者,从很小的时候就开始与极度的、永不满足的饥饿作斗争,该病可导致早发的严重肥胖。FDA批准Imcivree是基于迄今为止针对POMC、PCSK1或LEPR缺陷所致肥胖的最大规模研究结果。在3期临床试验中,由POMC或PCSK1缺陷引起的肥胖症患者中、由LEPR缺陷引起的肥胖症患者中,分别有80%和45.5%在接受Imcivree治疗一年后体重减轻超过10%。
2020年12月,评估Imcivree治疗Bardet-Biedl综合征(BBS)患者和Alström综合征患者无法满足的饥饿和严重肥胖的一项关键3期研究获得成功,结果显示,研究达到了主要终点和全部关键次要终点:患者体重和饥饿评分在统计学上显著和临床意义的降低。所有主要终点应答者均为BBS患者。有3例可评估的Alstrom综合征患者,但都没有达到主要终点。Rhythm计划在2021年下半年完成向美国FDA和欧盟EMA提交setmelanotide治疗BBS的监管申请文件。该公司计划在完成对该试验最终数据的全面分析后,确定setmelanotide在Alstrom综合征方面的开发路径。(生物谷Bioon.com)
原文出处:Rhythm Pharmaceuticals Announces Positive Data with Setmelanotide in Additional MC4R Pathway Deficiency-related Obesities
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->