《免疫》:最毒乳腺癌“套牢”T细胞,把抗癌免疫主力挡在肿瘤之外!
来源:网络 2023-12-05 17:21
虽说本次研究没有明确中性粒细胞表面与Chi3l1结合的具体受体,但研究者们认为直接以Chi3l1为治疗靶标就够了,毕竟它不仅会阻碍T细胞向肿瘤浸润
在《细胞》子刊《免疫》(Immunity)上,加拿大麦吉尔大学团队就发表了一项三阴性乳腺癌领域(TNBC)的最新“战报”,首次揭示TNBC的又一种狡猾高招:TNBC分泌的细胞因子Chi3l1可招募中性粒细胞进入肿瘤微环境,并形成中性粒细胞胞外陷阱(NETs),导致CD8+T细胞被拦阻在肿瘤间质中,无法浸润到肿瘤部位杀伤癌细胞[1],这招着实毒辣啊。

论文核心内容总结
TNBC可以说是当前治疗难度最大、患者预后最差的一类乳腺癌,这与其非常不利的免疫微环境高度相关,虽说PD-1/L1抑制剂联合化疗的方案已取得了一定进展,但从我国学者提出的“复旦分型”[2]来看,只有一小部分TNBC属于较适合使用免疫治疗的类型,大多数TNBC肿瘤中仍缺少充分的免疫细胞浸润,“免疫沙漠”名副其实。
而麦吉尔大学William Muller教授团队在2019年提出的另一种TNBC分型法,则是从空间组学角度指出一部分TNBC之所以成为免疫“冷肿瘤”,是因CD8+T细胞发生了所谓“间质限制”(stromal restriction),它们被阻隔在肿瘤间质、无法实质性接触癌细胞[3],幕后黑手则可能是转录因子STAT3,William Muller教授团队此前就发现它会促进TNBC增殖和转移[4]。
因而在本次研究中,William Muller教授团队首先对比了STAT3敲除模型小鼠和野生型小鼠的转录组,寻找STAT3介导TNBC免疫抑制的下游机制,而表达差异最大的基因(下调)中就有Chi3l1,它全称为壳多糖酶3样蛋白1,既往研究显示,Chi3l1可能参与了肿瘤微环境中巨噬细胞向M2型的极化,并促进黑色素瘤等癌种的远处转移[5-6],足以成为怀疑对象。
外部数据库资料则显示,Chi3l1最多见于基底型乳腺癌,这类乳腺癌恰好大多是TNBC,且主要由增生性的上皮细胞分泌,这部分细胞可就是“半步癌变”了。免疫荧光染色也证实,Chi3l1在空间组学TNBC分型的“间质限制”型肿瘤中表达最多,还与STAT3的激活状态、CD8+T细胞浸润受限均呈正相关,那怀疑对象就该变成犯罪嫌疑人了。
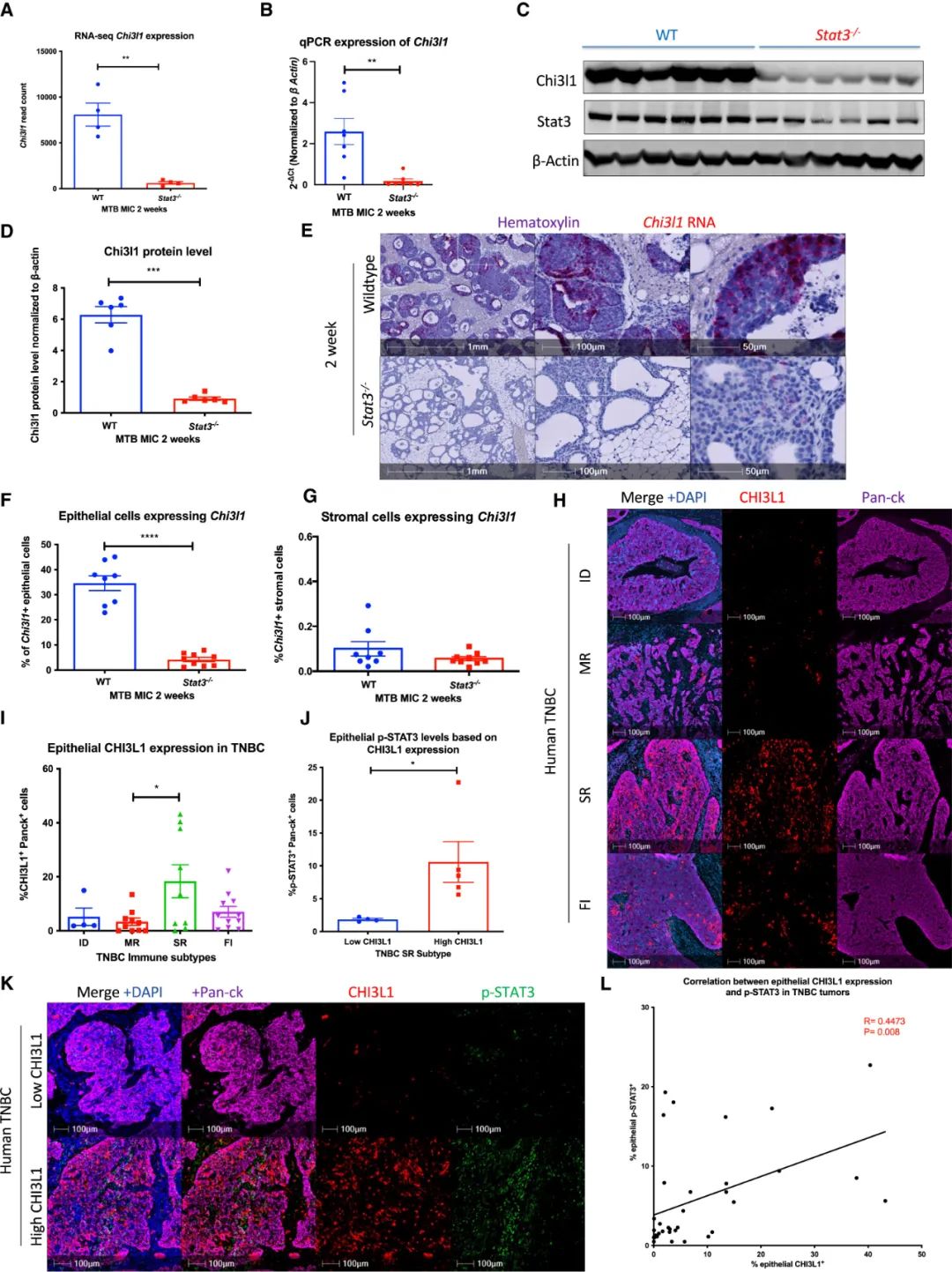
Chi3l1表达水平高度依赖于STAT3的激活
研究者们以CRISPR技术敲除Chi3l1,即可极大地延缓乳腺癌模型小鼠肿瘤的发生和肿瘤进展:一般情况下只需45天就会形成的肿瘤,在Chi3l1缺失小鼠身上要到130天时才会成型,这种延缓作用就是免疫系统见效的表现,因为敲除Chi3l1会使肿瘤内浸润的CD8+/CD4+T细胞数量显著增多,且激活状态更好,巨噬细胞也向有利免疫应答的M1型极化了。
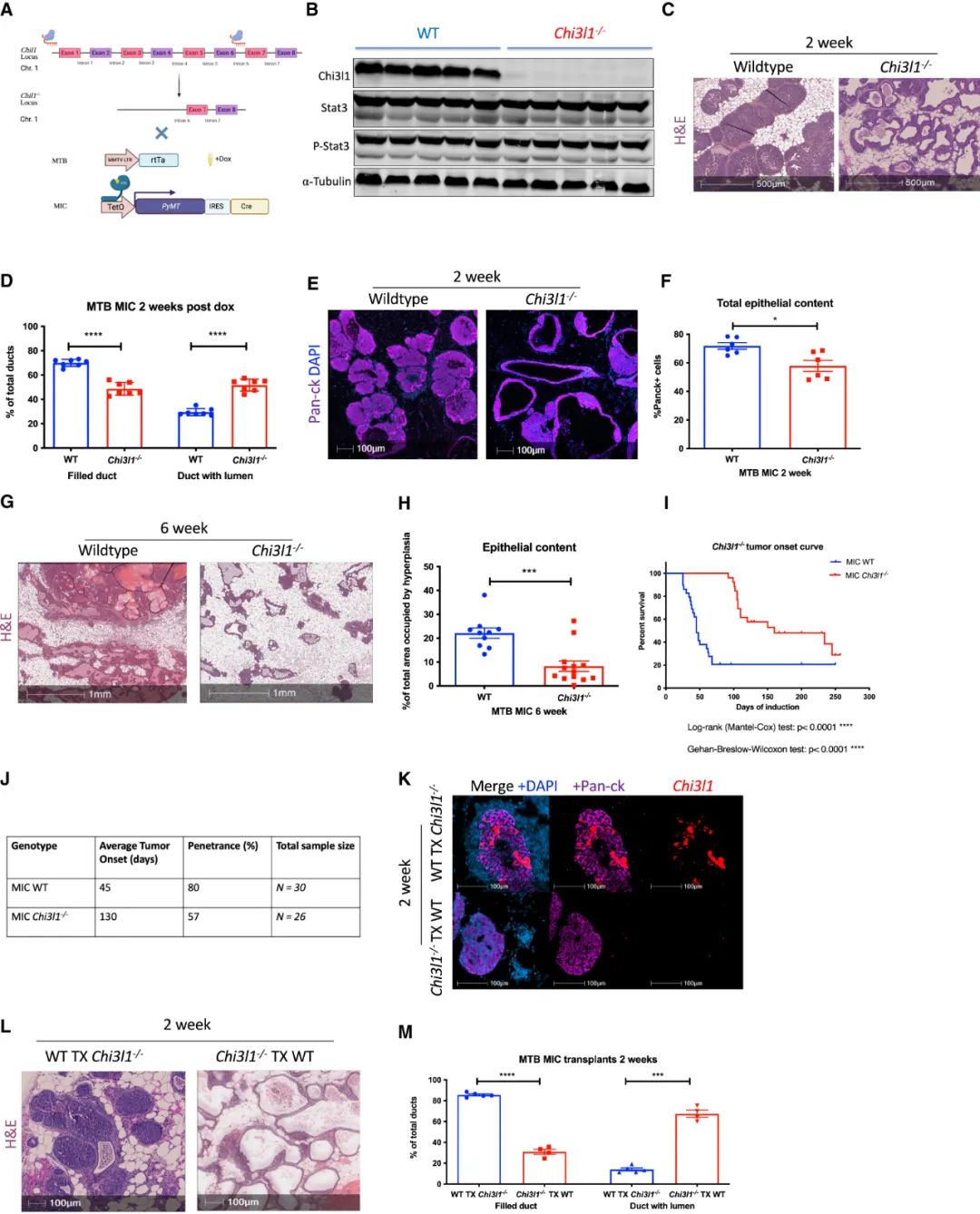
敲除Chi3l1可极大地延缓乳腺癌模型小鼠肿瘤的发生和肿瘤进展
换句话说,Chi3l1是STAT3介导TNBC免疫抑制时的关键帮凶,有它就没有免疫细胞浸润,而且抑制Chi3l1能与PD-1抑制剂形成协同增效,那就必须剖析Chi3l1是如何逞凶的了。空间组学分析初步显示,Chi3l1仅会限制T细胞而不影响其它类型免疫细胞对肿瘤的浸润,但这并不意味着Chi3l1只会直接作用于T细胞,不然它也是双拳难敌N手。
在敏锐地注意到敲除Chi3l1会使中性粒细胞总数减少、中性粒细胞炎性溶解(NETosis)变少后,研究者们通过细胞实验确定Chi3l1有募集中性粒细胞的功能,而且TNBC等癌种中的CD8+T细胞周围往往就有中性粒细胞存在,它们很可能是导致T细胞浸润受限的关键。
用单抗清除掉中性粒细胞后,Chi3l1促进乳腺癌形成的作用就被狠狠“腰斩”,而肿瘤微环境中的T细胞总数虽未明显改变,但突破间质成功浸润到肿瘤中的CD8+/CD4+T细胞明显增多,成为成功抑癌的关键;进一步实验还证实,中性粒细胞并未通过释放蛋白酶抑制T细胞的募集,它们就是在Chi3l1的调控下,“自杀性”形成NETs来阻止T细胞的浸润。
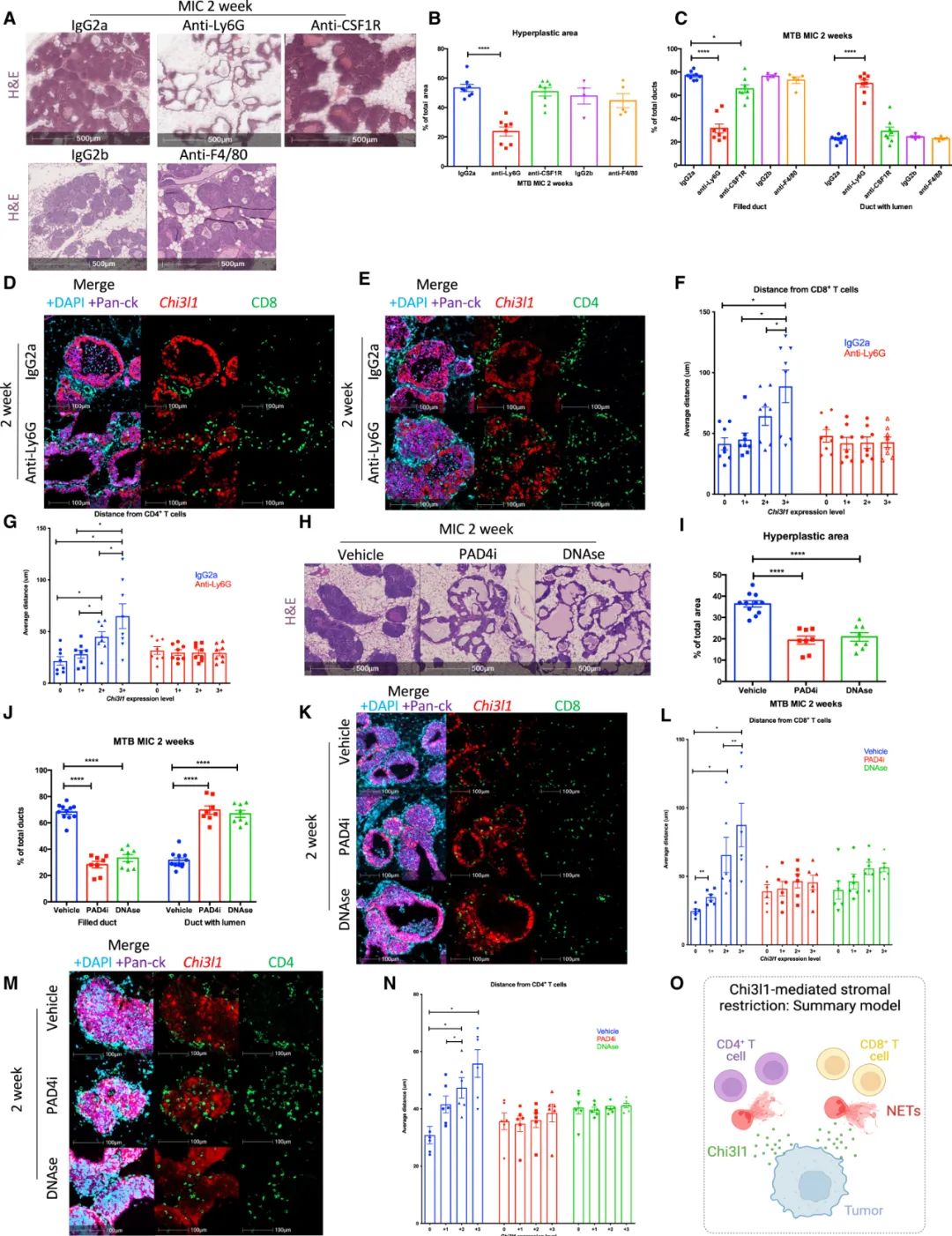
Chi3l1调控中性粒细胞“自杀性”形成NETs,阻止T细胞向肿瘤浸润
虽说本次研究没有明确中性粒细胞表面与Chi3l1结合的具体受体,但研究者们认为直接以Chi3l1为治疗靶标就够了,毕竟它不仅会阻碍T细胞向肿瘤浸润,还会通过调控PD-L1表达水平限制抗肿瘤免疫应答[7],可以说是作恶多端。靶向它再配合现有免疫治疗,说不定就能攻破一系列免疫抑制性极其显著的实体瘤呢。
参考文献:
[1]Taifour T, Attalla S S, Zuo D, et al. The tumor-derived cytokine Chi3l1 induces neutrophil extracellular traps that promote T cell exclusion in triple-negative breast cancer[J]. Immunity, 2023.
[2]Jiang Y Z, Ma D, Suo C, et al. Genomic and transcriptomic landscape of triple-negative breast cancers: subtypes and treatment strategies[J]. Cancer Cell, 2019, 35(3): 428-440. e5.
[3]Gruosso T, Gigoux M, Manem V S K, et al. Spatially distinct tumor immune microenvironments stratify triple-negative breast cancers[J]. The Journal of Clinical Investigation, 2019, 129(4): 1785-1800.
[4]Jones L M, Broz M L, Ranger J J, et al. STAT3 establishes an immunosuppressive microenvironment during the early stages of breast carcinogenesis to promote tumor growth and metastasis[J]. Cancer Research, 2016, 76(6): 1416-1428.
[5]Kim E G, Kim M N, Hong J Y, et al. Chitinase 3-like 1 contributes to food allergy via M2 macrophage polarization[J]. Allergy, Asthma & Immunology Research, 2020, 12(6): 1012.
[6]Ma B, Kamle S, Akosman B, et al. CHI3L1 enhances melanoma lung metastasis via regulation of T cell co-stimulators and CTLA-4/B7 axis[J]. Frontiers in Immunology, 2022, 13: 1056397.
[7]Ma B, Akosman B, Kamle S, et al. CHI3L1 regulates PD-L1 and anti-CHI3L1-PD-1 antibody elicits synergistic antitumor responses[J]. The Journal of Clinical Investigation, 2021, 131(21): e137750.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


