Cell子刊:沈少明/陈国强/苏冰合作揭示mTORC1感应氨基酸的普适性机制
来源:生物世界 2023-11-20 09:44
上海交通大学医学院沈少明研究员、陈国强院士和苏冰教授课题组合作,在 Cell 子刊 Cell Metabolism 发表了题为:The tRNA-GCN2-FBXO22 axis-mediated m
上海交通大学医学院沈少明研究员、陈国强院士和苏冰教授课题组合作,在 Cell 子刊 Cell Metabolism 发表了题为:The tRNA-GCN2-FBXO22 axis-mediated mTOR ubiquitination senses amino acid insufficiency 的研究论文。
该研究首次发现细胞内各种氨基酸浓度的改变可以统一地通过mTOR泛素化来被细胞感知,并进一步在机制上详细解释了mTORC1广泛感知所有氨基酸浓度波动的原理。

我们知道,每一种氨基酸均有其对应的转运RNA(tRNA),在其相应氨基酸充足的条件下,被氨酰tRNA合成酶催化形成氨酰tRNA。如果氨基酸缺失,非氨酰化的tRNA(uncharged tRNA)将累积,并快速激活GCN2激酶。活化的GCN2直接磷酸化位于FBXO22核定位信号邻位的T127位点,导致FBXO22滞留于细胞浆与mTOR作用,诱导mTOR K2066位点的K27泛素化。K2066位于mTOR的FRB结构域,该结构域与RAPTOR和mLST8组成mTORC1的底物识别口袋。
mTORC1的经典抑制剂雷帕霉素(Rapamycin)就是通过结合于FRB结构域并占据该口袋,阻碍底物的募集,从而实现对mTORC1活性的抑制。通过分子对接(molecular docking),他们发现mTOR泛素化发挥了类似于雷帕霉素的作用,并用实验证明mTOR泛素化阻碍了mTORC1对底物的识别,从而发生活性抑制。
随后,他们通过将细胞培养液中的氨基酸逐一剔除,发现任一类型氨基酸的缺失均可引起mTOR发生泛素化,并且mTOR泛素化介导了多种类型氨基酸缺失情况下mTORC1的活性抑制。在此基础上,发现氨基酸饥饿引起mTOR泛素化这一现象在小鼠体内同样存在,并且通过构建mTOR-K2066基因突变小鼠,证明该通路在感应膳食中氨基酸不足的过程中发挥重要作用。
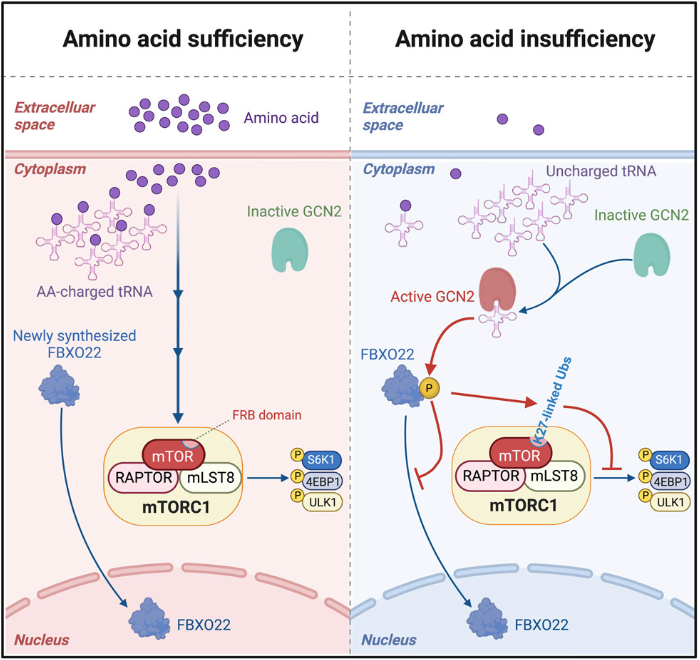
图1:氨基酸缺失诱导mTOR泛素化抑制mTORC1活性机制图
综上所述,这项工作首次揭示了mTORC1可以普遍感应氨基酸变化的新通路和机制。区别于已知的亮氨酸、精氨酸等少数氨基酸依赖于特定感应器被mTORC1感应的模型,该研究创新性地提出各种类型氨基酸缺失均可通过uncharged tRNA-GCN2-FBXO22轴引起的mTOR泛素化被mTORC1感应。这一普适性氨基酸感应通路的发现,为mTORC1感应细胞内氨基酸水平以精细调控生命活动提供了新的视角,为药物和食物疗法治疗mTORC1失调相关疾病提供了新的可能。
上海交通大学医学院附属仁济医院衰老与组织修复研究院沈少明研究员、海南医学院海南医学科学院陈国强院士及上海市免疫学研究所苏冰教授为本文共同通讯作者。上海交通大学医学院病理生理学系博士后葛梦凯和上海交通大学医学院附属仁济医院衰老与组织修复研究院博士后张铖为论文共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


