Cell:我国科学家揭示人类μ型阿片受体识别吗啡和芬太尼的分子机制
来源:生物谷原创 2022-11-25 09:25
我国研究人员报告并分析了诸如芬太尼、吗啡和奥利替丁之类的阿片类镇痛剂激活的人类μOR的高分辨率低温电镜结构,从而首次揭示了芬太尼和吗啡诱发μOR的识别和激活机制。
疼痛,尤其是慢性疼痛,是一种常见的神经系统现象。最常见的慢性疼痛包括腰痛、关节炎疼痛、偏头痛和癌症疼痛---所有这些都严重影响人们的身体和精神健康。阿片类药物,如吗啡和芬太尼(fentanyl),是目前使用最广泛的强效止痛药物。它们通过作用于称为阿片类受体(opioid receptor)的G蛋白偶联受体而产生镇痛效果。
临床上使用的大多数阿片类药物都是μ型阿片受体(μ opioid receptor,μOR)的激动剂。使用阿片类药物会引起许多副作用,包括成瘾、呼吸抑制和便秘。
以前有报道说,阿片类药物的镇痛作用是通过G蛋白信号通路介导的,而它们的副作用是由μOR的arrestin信号通路引起的。然而,缺乏对μOR的G蛋白偏向信号传导机制的分子理解,极大地阻碍了合理设计和发现G蛋白偏向的μOR激动剂,以实现潜在的更安全的疼痛治疗。
在一项新的研究中,来自中国科学院上海药物研究所的研究人员报告并分析了诸如芬太尼、吗啡和奥利替丁(oliceridine)之类的阿片类镇痛剂激活的人类μOR的高分辨率低温电镜(cryo-EM)结构,从而首次揭示了芬太尼和吗啡诱发μOR的识别和激活机制。相关研究结果发表在2022年11月10日的Cell期刊上,论文标题为“Molecular recognition of morphine and fentanyl by the human μ-opioid receptor”。
这些作者首先获得了人类μOR与平衡激动剂(比如芬太尼、吗啡)和拟肽Tyr-D-Ala-Gly-N-Me-Phe-Gly-ol(DAMGO)结合在一起时的三维结构。这些激动剂同时表现出G蛋白和arrestin的信号传导活性。他们还解析出μOR与G蛋白偏向性激动剂(比如TRV130、SR17018和PZM21)结合在一起时的三维结构。
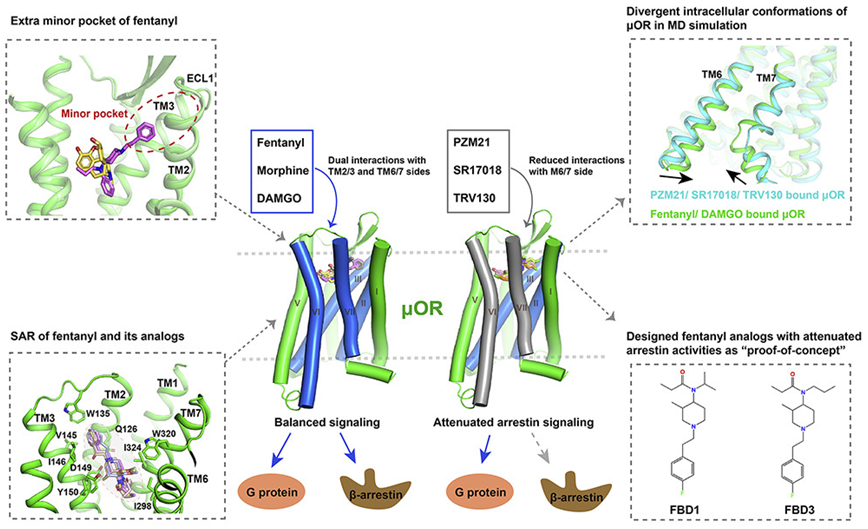
他们随后通过细胞水平的功能分析和分子动力学模拟分析了μOR在不同信号激动剂激活下的信号传导特性。他们的结果显示,与吗啡相比,芬太尼在μOR的细胞外侧TM2和TM3周围占据了一个额外的结合口袋。
此外,芬太尼的苯胺环侧链与氨基酸残基W295和Y328形成π-π疏水相互作用。芬太尼与μOR更广泛的相互作用导致芬太尼的效力比吗啡高50-100倍。
基于芬太尼与μOR结合的结构,这些作者利用分子对接和诱变研究进一步探讨了芬太尼及其衍生物与μOR的结构-活性关系。他们发现,芬太尼和芬太尼类似物的效力与这些配体与μOR氨基酸残基(比如D149、Y150、W135和W320)的不同程度的相互作用高度相关。
图片来自Cell, 2022, doi:10.1016/j.cell.2022.09.041。
深入的结构分析和分子动力学模拟显示,G蛋白偏向性激动剂(比如PZM21)倾向于结合到μOR配体结合口袋的TM2/3侧。相比之下,芬太尼和DAMGO等平衡型激动剂与μOR跨膜结构域显示出更广泛和平衡的相互作用,导致μOR有一个更紧凑的细胞内腔。这有利于μOR的arrestin偶联,从而解释了μOR的arrestin活性所必需的分子决定因素。
芬太尼及其类似物构成了“阿片类药物危机”的主要原因。然而,它们如何结合和激活μOR仍然难以捉摸。这项新的研究首次提出了芬太尼结合μOR的结构,并揭示了与吗啡相比芬太尼的特殊结合模式。
这项新的研究提供了对芬太尼及其类似物的结构-活性关系的深入了解。它还通过组合使用多种功能分析和分子动力学模拟,增加了对μOR的偏向激动性和配体选择性的分子理解。它加深了对μOR信号传导的调节机制的理解,并可能促进开发副作用更小的下一代阿片类镇痛药。(生物谷 Bioon.com)
参考资料:
Youwen Zhuang et al. Molecular recognition of morphine and fentanyl by the human μ-opioid receptor, Cell, 2022, doi:10.1016/j.cell.2022.09.041.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


