Protein & Cell|清华大学医学院那洁组揭示长非编码RNA LncSync调控小鼠心肌稳态及心脏肥大的作用
来源:清华大学 2023-03-22 17:12
本研究揭示了一个在小鼠心脏中富集的lncRNA的生理功能,并阐释了背后的分子机制。研究结果为心脏病理性肥厚的发病机理提供新的线索,也为相关疾病的临床治疗提供了潜在的分子靶点。
2023年3月18日,清华大学医学院那洁课题组于Protein & Cell发表题为“Long non-coding RNA LncSync regulates mouse cardiomyocyte homeostasis and cardiac hypertrophy through coordination of miRNA actions”的研究论文。该论文首次发现长链非编码RNA (Long non-coding RNA, lncRNA) LncSync可以通过加工合成miRNA调控心肌细胞稳态维持,敲除LncSync导致小鼠发生病理性心脏肥大。
心脏是在胚胎发育中第一个行使功能的器官,是循环系统的中心,搏动到生命的最后一刻。心脏发育和生理功能受到能量代谢、信号传导、细胞骨架、RNA代谢等多方面调控。调控的紊乱会导致心脏病变,很多慢性心脏病变最终会发展成心力衰竭。心力衰竭早期通常表现为病理性心肌肥厚,因此了解病理性心肌肥厚的各种发生机制,可为临床治疗提供新的思路。
LncSync是一个位于X染色体上,在哺乳动物中保守的基因。LncSync是miR-351簇microRNA的host RNA,也是miR-181的靶标RNA,在小鼠胚胎心脏,尤其是心肌细胞中特异性高表达,提示它在心肌中可能具有重要功能。研究人员在小鼠中敲除了LncSync,发现在胚胎期, LncSync缺失虽然导致心脏中许多代谢相关基因表达异常,但小鼠在成年后才逐渐呈现病理性心脏肥大,到24周龄非常显著。 LncSync敲除小鼠从13周可检测到原发性血压升高。这一系列表型说明LncSync的敲除可能使心肌稳态失衡,逐渐发生心脏病理性肥大(图1)。
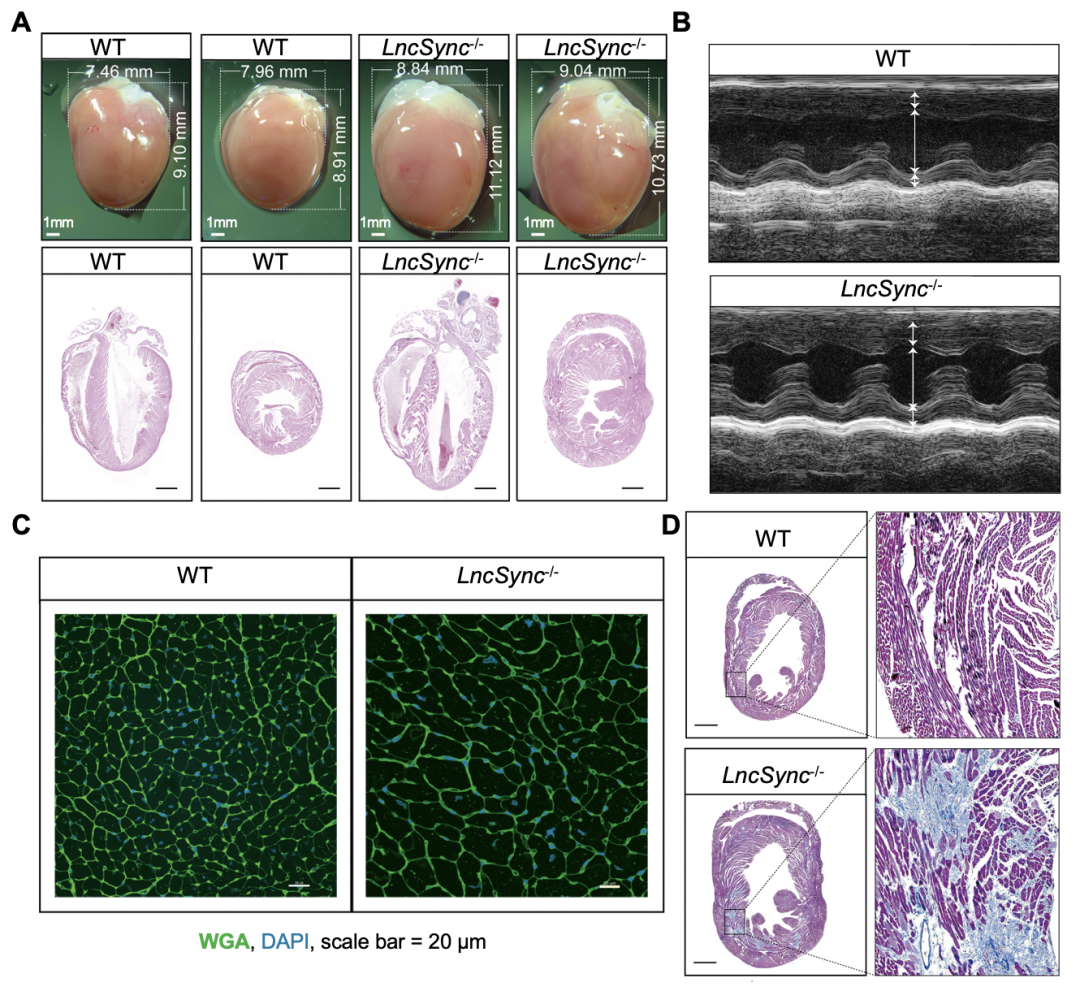
图1 LncSync敲除小鼠发生病理性心脏肥大
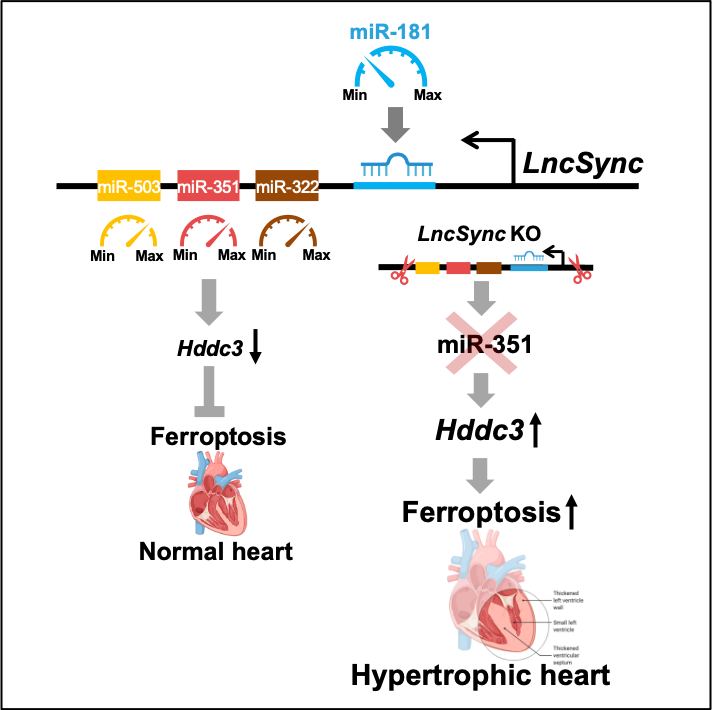
图2 LncSync新颖的调控模式
LncSync及其衍生的miR-351簇microRNA可能起到类似分子变阻器的作用。生理情况下,小鼠心脏内的miR-351压低Hddc3水平,抑制铁焦亡通路的激活。LncSync敲除后miR-351缺失,Hddc3水平上升,铁焦亡通路激活,长时间的心肌稳态失衡导致心脏肥大。LncSync水平可受miR-181水平控制,使它能响应循环系统生理和病理变化引起的miR-181水平改变,从而调控心肌稳态。
本研究揭示了一个在小鼠心脏中富集的lncRNA的生理功能,并阐释了背后的分子机制。研究结果为心脏病理性肥厚的发病机理提供新的线索,也为相关疾病的临床治疗提供了潜在的分子靶点。LncSync敲除小鼠有可能做作为慢性原发性心脏肥大和铁焦亡的小动物模型。另外LncSync与miRNA构成的调控通路可起到特异性和弹性调控的作用,帮助维持组织稳态,是一种新型的非编码RNA调控模式。
那洁副教授为该论文通讯作者,清华大学医学院已毕业博士生黄如金为本文第一作者。本课题与北京大学分子医学研究所汪阳明教授、首都医科大学附属安贞医院心肺血管疾病研究所李玉琳教授通力合作完成。那洁实验室的博士生刘金阳、丁双元及已毕业博士生陈曦也对本研究做出了重要贡献。北京大学何爱彬实验室、清华大学郗乔然实验室也为本研究提供了重要帮助。本研究由国家干细胞及转化研究重点专项,国家自然科学基金委和清华-北京大学联合生命科学中心等提供经费支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


