Nat Cell Biol | 武汉大学姜恺等团队合作发现CAMSAPs和成核促进因子控制微管释放γ-TuRC
来源:生物探索 2024-03-05 15:30
该研究表明,在CAMSAP2或CAMSAP3存在的情况下,γ-TuRC的重复活性可以导致稳定的微管负端产生,这些负端不直接附着在它们的成核位点上。
武汉大学姜恺及荷兰乌得勒支大学Anna Akhmanova共同通讯在Nature Cell Biology 在线发表题为“CAMSAPs and nucleation-promoting factors control microtubule release from γ-TuRC”的研究论文,该研究发现CAMSAPs和成核促进因子控制微管释放γ-TuRC。该研究用纯化的成分在体外重建了这个过程。研究发现所有CAMSAPs都能与γ-TuRC连接的微管的负端结合。CAMSAP2和CAMSAP3修饰和稳定生长负端,而不是负端跟踪蛋白CAMSAP1,诱导微管释放γ-TuRC。
γ-TuRC相互作用物CDK5RAP2和微管生长调节剂CLASP2强烈刺激γ-TuRC依赖性微管成核,但只有CDK5RAP2抑制CAMSAP与γ-TuRC锚定负端的结合及其释放。CDK5RAP2还提高了含有γ-微管蛋白复合物对13-而不是14-原丝微管的选择性。细胞敲除和过表达实验表明,CDK5RAP2抑制CAMSAP2结合的微管的形成,这些微管与微管组织中心分离。该研究认为CAMSAPs可以从γ-TuRC释放新成核的微管,而成核促进因子可以通过差异调节这一过程。

动物细胞中的微管组织是细胞结构和极性的主要决定因素。这种组织在很大程度上取决于微管组织中心(MTOCs)的活性,这种结构可以使微管成核,并稳定和固定微管的负端。细胞中主要的微管成核因子是γ-微管蛋白环复合物(γ-TuRC)。γ-TuRC的定位和活性受多种因素控制,如augmin、pericentrin、CDK5RAP2和chTOG。
γ-TuRC也可以覆盖微管负端并参与其锚定,这可能需要额外的微管组织中心组分的帮助。另一种被充分研究的负端稳定和锚定途径依赖于CAMSAP或Patronin家族的成员。这些蛋白质专门识别游离的,无帽微管的负端,因为它们的特征结构域CKK结合在爆发的原丝之间的负端特异性位点上。CAMSAP2可以独立于γ-TuRC形成微管核。
在γ-TuRC覆盖的微管中,负端的原丝是直的;因此,它们不应该能够绑定到CAMSAP。然而,最近的研究表明,γ-TuRC是不对称的,其结构与13-原丝微管不完全匹配。这一发现提出了一种可能性,即γ-TuRC核微管可能没有完全附着在它们的模板上,并且一些原丝可能具有允许CAMSAP结合的爆发构象。此外,由于纯化的γ-TuRC的微管成核活性很低,刺激微管成核的潜在机制可能是改变γ-TuRC的构象,使其更接近微管结构。
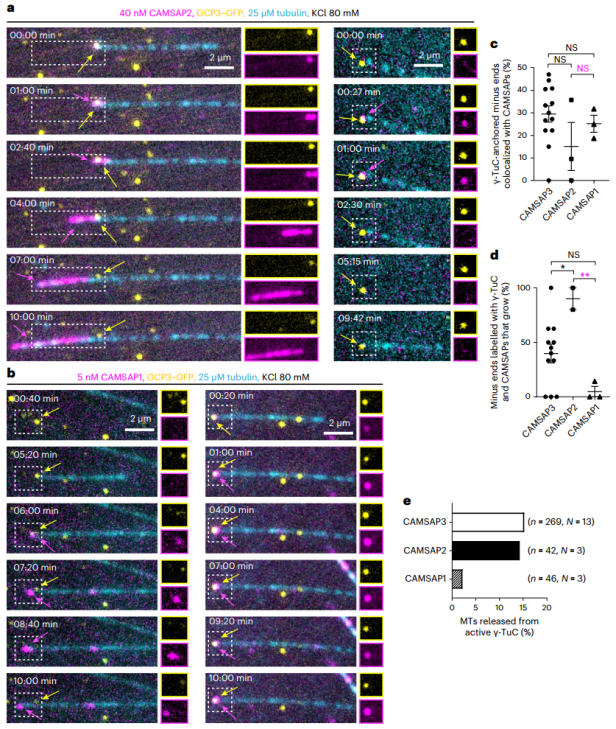
CAMSAPs通过修饰生长中的微管负端导致γ-TuRC脱离(Credit: Nature Cell Biology)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


