研究解析ABA信号转导途径关键调控机制
来源:分子植物科学卓越创新中心 2021-05-05 10:05
中国科学院分子植物科学卓越创新中心研究员王鹏程研究组等在Nature Communications上发表研究论文Initiation and amplification of SnRK2 activation in ABA signaling,揭示了植物激素脱落酸(ABA)信号通路中核心组分SnRK2激活过程中的起始-放大机制。干旱、高盐、低温等胁迫诱导植物
中国科学院分子植物科学卓越创新中心研究员王鹏程研究组等在Nature Communications上发表研究论文Initiation and amplification of SnRK2 activation in ABA signaling,揭示了植物激素脱落酸(ABA)信号通路中核心组分SnRK2激活过程中的起始-放大机制。
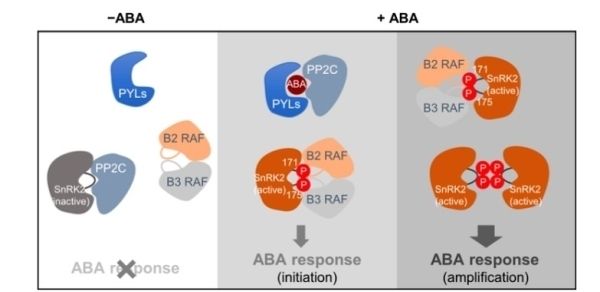
干旱、高盐、低温等胁迫诱导植物激素ABA含量的增加。ABA促进休眠、减少水分散失、抑制植物生长、诱导胁迫相关基因的表达等,促进植物对胁迫环境的适应,是植物重要的“抗逆激素”。已知植物特有的蛋白激酶SnRK2是ABA受体偶联核心信号途径(receptor-coupled core signaling)的核心组分。在非胁迫条件下,A组PP2C家族的蛋白磷酸酶结合并去磷酸化SnRK2,阻断ABA信号途径和逆境响应。干旱等胁迫环境诱导ABA的产生或者释放。ABA与受体PYR/PYLs/RCARs蛋白结合形成复合体,结合并抑制PP2C。SnRK2从PP2C抑制的状态中释放出来,活化的SnRK2磷酸化下游转录因子、离子通道等,激活ABA信号通路和胁迫应答过程。在这一过程中,植物体内的SnRK2从无活性的去磷酸化状态转换为激活状态,是植物应答ABA以及环境胁迫过程的核心环节。
2020年初,王鹏程研究组与Julian Schroeder研究组、Yamaguchi-Shinozaki研究组,几乎同时在Nature Communications上发表研究论文,发现B亚组RAF家族蛋白激酶介导了SnRK2的磷酸化和激活过程。研究中,为了探究少量激活的RAF如何快速诱导SnRK2的激活,科研人员利用SnRK2.6上M94G的这一氨基酸的点突变,扩大SnRK2蛋白激酶的ATP Binding Pocket(ATP结合口袋),并在体外反应中引入一种苯基修饰的ATP,SnRK2.6 M94G可以利用这种ATP类似物进行激酶自身的硫代磷酸化(Thiophosphorylation)以及对底物的硫代磷酰化,而正常的RAF和SnRK2.6不能利用这种ATP类似物,以此区分RAF对SnRK2的磷酸化和SnRK2的自磷酸化。借助这一技术发现了RAF磷酸化并激活SnRK2后,被激活的SnRK2.2/3/6通过分子间硫代磷酰化并激活其它尚未活化的SnRK2激酶,迅速地放大ABA信号途径。
王鹏程研究组构建了新的B2和B3亚组RAF的多突变体材料,发现B2和B3亚组RAF蛋白激酶共同参与ABA信号转导过程。B2和B3亚组RAF多突变体OK100-nonu表现出与snrk2.2/3/6三突变体以及pyl多突变体类似ABA不敏感表型,可以在高浓度ABA处理下萌发和生长。OK100-nonu在气孔运动、生长发育、胁迫应答等方面表型出与snrk2.2/3/6三突变体以及pyl多突变体类似。在OK100-nonu突变体中,ABA不能激活SnRK2。因此,B2和B3亚组RAF是ABA信号途径中的核心组分。
该研究对现有的植物ABA受体偶联的信号通路做出了重要修订:ABA-PYL-PP2C负责SnRK2的结合抑制或释放,而RAF通过磷酸化介导SnRK2的自激活启动SnRK2的活化过程。这一起始-放大的激酶激活过程或是蛋白激酶偶联途径的普遍机制。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


