Nat Cell Biol| 武汉大学刘勇团队揭示内质网应激中IRE1α集群形成与细胞应激颗粒组装的耦合机制
来源:生物探索 2024-05-12 10:56
该研究揭示了IRE1α-SG凝聚物时空组装的相变机制,从而建立了更高效的IRE1α机制,从而实现更高的应力处理能力。
武汉大学刘勇团队在Nature Cell Biology 在线发表题为“Mammalian IRE1α dynamically and functionally coalesces with stress granules”的研究论文,该研究表明哺乳动物IRE1α与应激颗粒动态功能结合。

真核细胞通过不同的应激反应机制来应对各种干扰细胞蛋白平衡的外部威胁,以维持细胞内稳态和生存。内质网(ER)是近三分之一的细胞蛋白质组折叠和成熟的主要部位。未折叠/错误折叠蛋白在内质网腔内的过度积累会引发内质网应激,激活由三种内质网跨膜信号转导介导的未折叠蛋白反应(UPR),即PKR样内质网激酶(PERK)、活化转录因子6 (ATF6)和肌醇要求酶1 (IRE1)。IRE1是从酵母到哺乳动物保存的最古老的内质网应激传感器,具有一个N端内质网管结构域(LD),用于检测未折叠/错误折叠的蛋白质负载,一个跨膜段,一个细胞质连接体和一个C端蛋白丝氨酸/苏氨酸激酶和核糖核酸内切酶(RNase)结构域。
在内质网胁迫下,IRE1通过寡聚化和反式自磷酸化被激活,导致其RNase活性被激活,选择性地切割X-box结合蛋白1 (XBP1)信使RNA或通过“调节IRE1依赖性衰变(RIDD)”降解选定的mRNA底物。在哺乳动物中,普遍表达的同种异构体IRE1α从Xbp1 mRNA中去除一个位于双发夹结构内的26个核苷酸内含子。RNA连接酶RtcB随后的连接产生Xbp1 mRNA的剪接形式和由此产生的转录活性XBP1s蛋白,启动一个关键的UPR分支来应对内质网应激。大量研究已经证实IRE1α-XBP1通路在细胞命运决定以及包括免疫、代谢和恶性肿瘤在内的许多生物学过程中起关键作用。
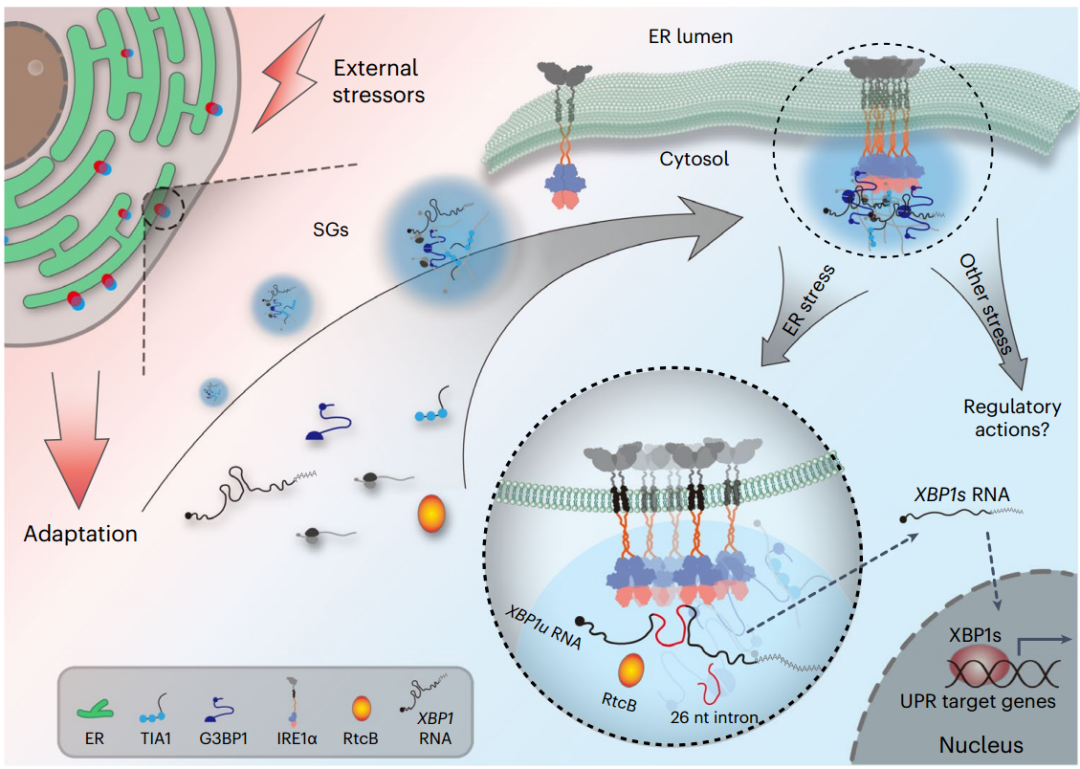
哺乳动物IRE1α与SGs的动态结合,以形成一个更有效的应激处理工作站(Credit: Nature Cell Biology)
内质网应力可诱导IRE1在活化过程中形成微观可见的大型IRE1团簇或焦点,这是IRE1凝析物高阶组装的一个突出特征。最近的超分辨率显微镜研究清楚地表明,非均质、不对称的IRE1α团簇具有复杂的拓扑结构,具有扩散约束的核心,这意味着它们可能不是典型的相分离液体凝聚物。动态地,小的IRE1α团簇可以在内质网胁迫中最初形成,随后通过明显的融合事件成长为更大的团簇。此外,IRE1α簇显示出显著的移动性,与它们的大小无关,表明可能与其他亚细胞结构相互作用。此外,内源性人IRE1α在基本条件下作为组成型二聚体存在,在内质网胁迫下可以组装成完全活性的凝析物,而不会形成大簇。因此,大型IRE1α簇组装是否受到特定的应激反应细胞内机制的调节并在功能上涉及应激管理仍然是一个谜。
细胞内生物分子凝聚物即无膜细胞器的组装通常通过液-液相分离(LLPS)形成,在细胞组织中起着重要作用,控制着RNA代谢、基因调控和细胞内信号传导等多种生化过程。应激颗粒(SGs)是典型的细胞质凝聚物或信使核糖核蛋白(RNP)颗粒,可以通过LLPS快速组装以响应蛋白质毒性条件,包括内质网应激、热休克(HS)、氧化应激或渗透应激。在应激细胞中,SG组装是由全局蛋白翻译阻滞启动的,通常伴随着eIF2α磷酸化。这一过程主要涉及无核糖体mRNAs和RNA结合蛋白之间的多价相互作用,包括G3BP1/G3BP2和TIA1,它们是关键的SGs成核支架因子。
显微镜研究表明,SGs具有层状结构,由稳定的核心亚结构组成,周围是更动态的相分离壳。值得注意的是,像SGs这样的RNP颗粒含有大量含有内在无序区(IDRs)的蛋白质,为相分离提供多价分子间相互作用。IDRs通常富含极性或带电氨基酸,如丝氨酸(S)、谷氨酰胺(Q)、甘氨酸(G)或谷氨酸(E)。最近,G3BP1/G3BP2被证明是核心SG网络的中心节点,G3BP1的三个不同的IDRs构成基于自抑制的分子开关,触发SG组分的相分离,以响应日益释放的mRNAs。
该研究表明,在哺乳动物细胞中,IRE1α簇的形成是内质网膜结合相分离事件,与应激颗粒(SGs)的组装耦合。在不同的应激源下,IRE1α簇在内质网动态地与SGs结合。IRE1α的细胞质连接体部分具有内在无序区域,是其与SGs缩合所必需的。此外,SG组装的破坏破坏了IRE1α的聚集并破坏了XBP1 mRNA的剪接,并且这种IRE1α-SG的结合导致内质网应激时促生存IRE1α-XBP1途径的生化成分的富集。该研究揭示了IRE1α-SG凝聚物时空组装的相变机制,从而建立了更高效的IRE1α机制,从而实现更高的应力处理能力。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


