《癌细胞》:难怪肝癌那么难治!中国科学家首次发现,肝癌竟让巨噬细胞将T细胞拦在肿瘤周围,互相活化、共同促癌
来源:奇点糕 2024-11-24 14:04
对于那些CD103阳性细胞毒性T细胞分布在瘤周的肝癌患者而言,重新分配CD103阳性细胞毒性T细胞的药物或许能提升免疫检查点抑制剂治疗肝癌的效果。
据世卫组织2022年发布的全球癌症数据,我国新发肝癌超过41万例,因肝癌死亡超过39万例[1]。此外,我国肝癌患者的5年生存率只有12.1%[2]。
不难看出,肝癌很不好治。这背后的原因有很多,不过最近一两年,不断有研究发现肝癌周围有一圈“防火墙”,其中都聚集着肿瘤相关巨噬细胞,它们将肿瘤特异性杀伤性T细胞阻挡在肿瘤的周围[3-5],让兵临瘤下的T细胞只能望瘤兴叹。
我原本以为肿瘤让巨噬细胞将T细胞挡在肿瘤之外就算完事儿了,万万没想到的是,肿瘤竟然还打起了聚集在周围的T细胞的主意。
近日,由中山大学生命科学学院邝栋明和魏瑗领衔的研究团队,在著名期刊《癌细胞》上发表一篇重要研究论文[6]。
他们的研究成果首次表明,肝癌细胞通过表观遗传学方法抑制趋化因子的表达;而部署在肿瘤周边的肿瘤相关巨噬细胞会高水平产生趋化因子,将肿瘤抗原特异性T细胞聚集在肿瘤周边,并激活T细胞;这些T细胞反过来又会激活巨噬细胞的炎症通路,招募并触发中性粒细胞介导的血管生成,最终促进肝癌的进展。
简单来说,肝癌一边降低对T细胞的吸引力,一边利用巨噬细胞引诱T细胞聚集在肿瘤周围,并借助T细胞的力量,促进自身的进展。不得不说,肝癌真是个操盘大师,难怪那么难治。中山大学的黄春祥、劳向明和王许燕是论文的共同第一作者。

▲ 论文首页截图
众所周知,只有一小部分肿瘤中富集细胞毒性T细胞(CTLs)的癌症患者能从PD-1/PD-L1抑制剂的治疗中获益,而且在接受免疫治疗后,一些患者的病情甚至会出现超进展。显然,我们对肿瘤微环境及其中的细胞毒性T细胞的认知还不够。
为了探明上述问题,邝栋明/魏瑗团队分析了5名肝癌患者的肿瘤组织、配对非肿瘤组织和血液样本的RNA测序数据。他们发现,肝癌肿瘤组织中确实存在CD103阳性的细胞毒性组织驻留记忆T细胞,而且这些T细胞具有肿瘤特异性。不难看出,在人体免疫系统确实在围攻肝癌。
然而出人意料的是,这些CD103阳性肿瘤反应性细胞毒性T细胞的比例和绝对数量在肝癌肿瘤组织中,尤其是晚期肝癌肿瘤中都有所增加。越是晚期的肿瘤组织中,CD103阳性肿瘤反应性细胞毒性T细胞越多,这种现象不太合乎逻辑。难道肿瘤反应性细胞毒性T细胞会促进肿瘤进展?
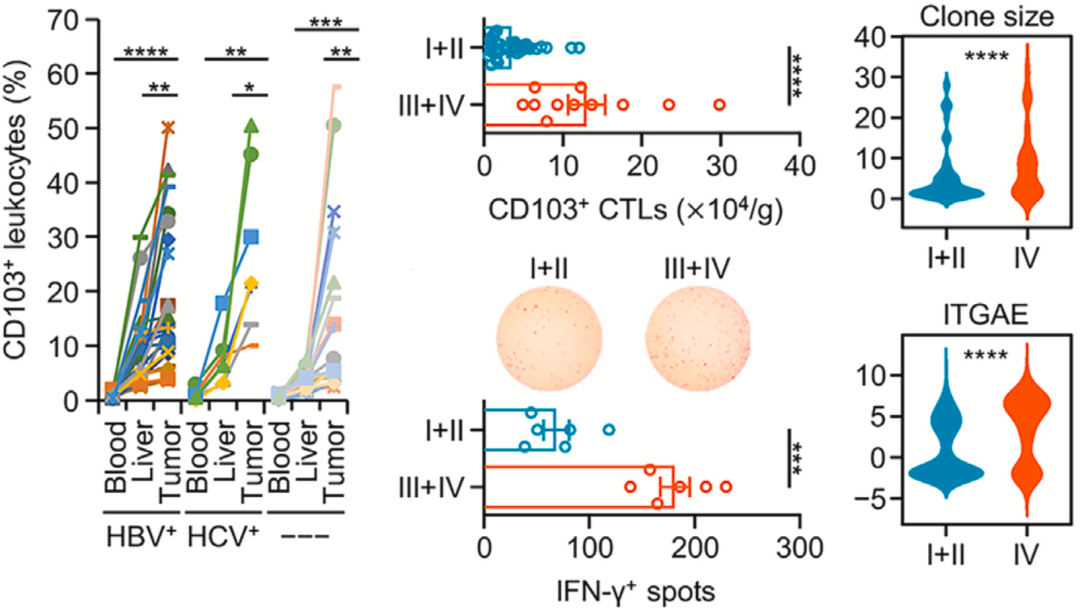
▲ 肝癌反应性CD103阳性细胞毒性T细胞随疾病进展而增加
上述现象让邝栋明/魏瑗团队对肝癌组织中CD103阳性细胞毒性T细胞的空间分布感到好奇。
于是,他们分析了100名肝癌患者的肿瘤组织。果然发现了异样,CD103阳性细胞毒性T细胞在肿瘤中的聚集主要在癌周区,尤其是晚期肝癌。相比之下,虽然瘤内CD103阳性细胞毒性T细胞的检出率很低,但它们的密度与疾病进展成负相关。
显然,CD103阳性细胞毒性T细胞在肿瘤中的定位,或许决定了它们抗不抗癌。后续分析也显示,癌周CD103阳性细胞毒性T细胞的比例是预测肝癌复发的独立因素,而瘤内CD103阳性细胞毒性T细胞的比例则是预后良好的独立因素,而癌周CD103阳性细胞毒性T细胞增多、瘤内CD103阳性细胞毒性T细胞稀少的肝癌患者预后最差。
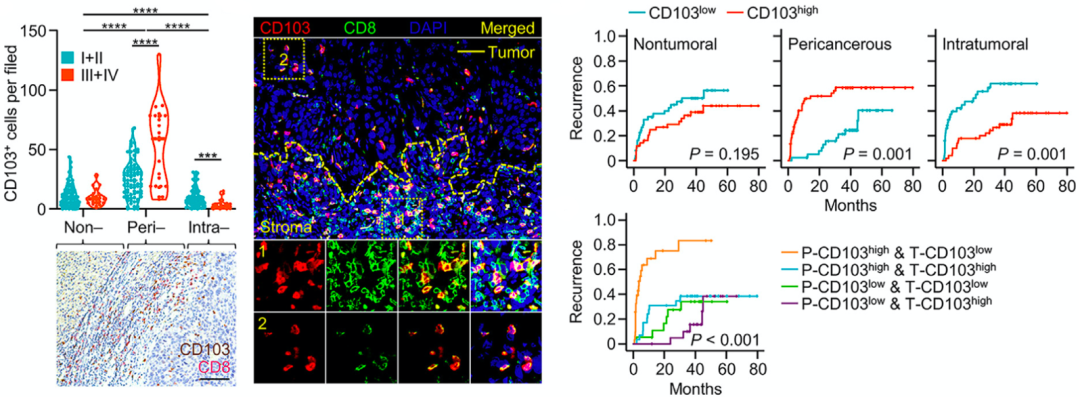
▲ CD103阳性细胞毒性T细胞的定位决定了抗不抗癌
在分析CD103阳性细胞毒性T细胞分布与免疫治疗之间的关系时,研究人员还发现,瘤内CD103阳性细胞毒性T细胞与癌周CD103阳性细胞毒性T细胞的比例,与PD-1抑制剂的疗效呈正相关。
通过对切除肿瘤后接受PD-1抑制剂治疗的8名患者的肝癌组织进行空间转录组学研究,他们进一步证实:瘤内CD103阳性细胞毒性T细胞浸润较高,且瘤内CD103阳性细胞毒性T细胞与癌周CD103阳性细胞毒性T细胞比例增加的肝癌患者,对PD-1抑制剂治疗有反应。
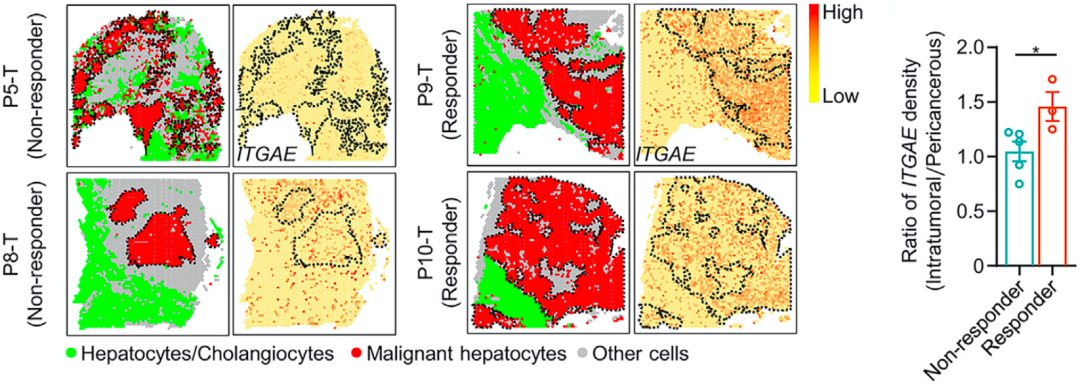
▲ CD103阳性细胞毒性T细胞分布影响免疫治疗的效果
接下来的问题是,这些CD103阳性细胞毒性T细胞为啥不进到肝癌组织里面去呢?它们在肿瘤周围是不是会促进癌症进展呢?
邝栋明/魏瑗团队发现,CD103阳性细胞毒性T细胞选择性表达CXCR3,但是DNA甲基转移酶1(DNMT1)在肿瘤中的表达选择性增加,这导致CXCR3配体CXCL9、CXCL10和CXCL11在肝癌肿瘤组织中的表达被抑制。
简单来说,肝癌瘤内的癌细胞通过表观遗传学过程,抑制了招募CD103阳性细胞毒性T细胞的细胞因子。既然如此,CD103阳性细胞毒性T细胞为啥还要聚集在肿瘤周围呢?
接下来的发现有点儿出人意料,原来肝癌会在肿瘤周围部署肿瘤相关巨噬细胞,这些巨噬细胞高表达CXCL9、CXCL10和CXCL11。在分析不响应PD-1抑制剂治疗的患者的肿瘤组织后,他们再次证实,表达CXCR3配体CXCL9、CXCL10和CXCL11的主要细胞类型是癌周巨噬细胞,而不是肝癌细胞。
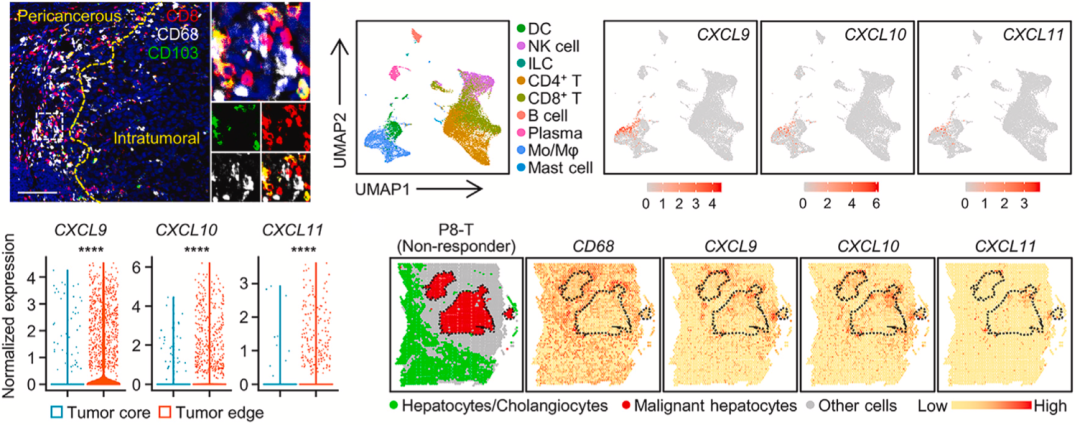
▲ 癌周巨噬细胞在吸引CD103阳性细胞毒性T细胞
在后续分析中,邝栋明/魏瑗团队还发现,癌周巨噬细胞会通过高表达HLA-DR和HLA-ABC(抗原呈递能力较高),迅速捕获CD103阳性细胞毒性T细胞,而肿瘤里的巨噬细胞不具备这种技能。
值得注意的是,这些分布在癌周的肿瘤相关巨噬细胞不仅没有发挥免疫抑制的作用,反而通过抗原呈递功能活化了被诱捕的CD103阳性细胞毒性T细胞,让CD103阳性细胞毒性T细胞增殖能力更强、产生更多的IFN-γ,表面脱颗粒标志物CD107a增加。
如此“激怒”T细胞,难道肝癌不怕死吗?
还真不是。因为研究人员发现了更奇怪的现象:虽然巨噬细胞激活了CD103阳性细胞毒性T细胞,但这一作用并没有导致巨噬细胞死亡,反而是通过一条神奇的通路反过来进一步活化巨噬细胞、促进癌症的进展。
具体来说,被巨噬细胞活化的CD103阳性细胞毒性T细胞,会向巨噬细胞投放穿孔素,这会导致钙离子流入巨噬细胞,进而激活NLRP3炎症小体,促进巨噬细胞释放IL-1β;IL-1β又会招募并激活中性粒细胞,进而通过促进血管生成的方式,促进肝癌的进展。
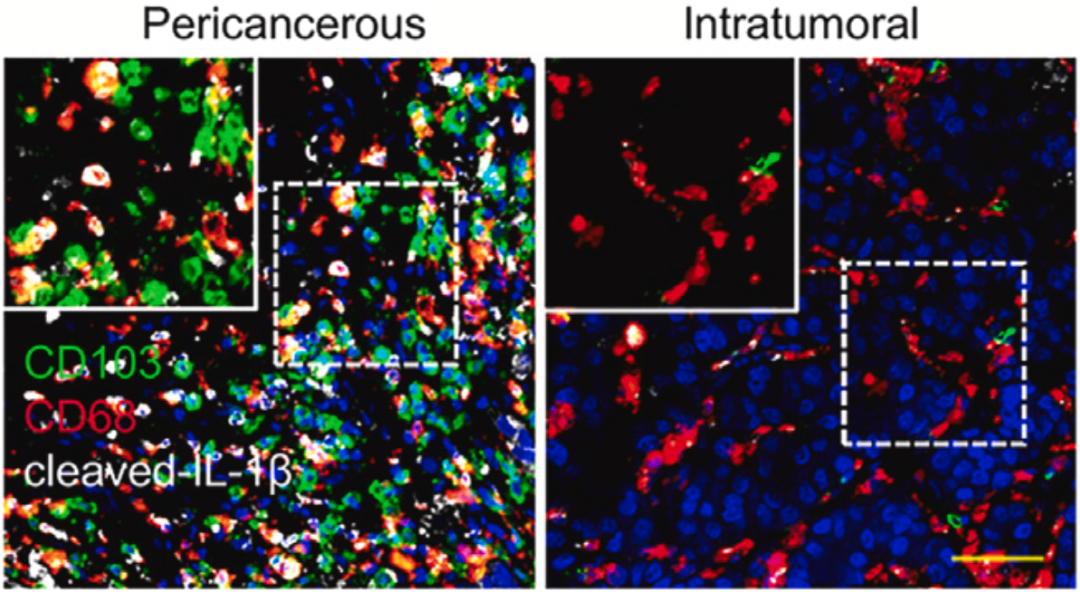
▲ 瘤内和瘤周免疫环境的差异
在将上述所有发现串联在一起之后,我们可以发现肝癌的高超三板斧。
①瘤内的肝癌细胞通过上调DNA甲基转移酶1的表达,通过甲基化抑制趋化因子CXCL9、CXCL10和CXCL11的表达,拒绝CD103阳性细胞毒性T细胞进入瘤内。
②而部署在肿瘤周围的巨噬细胞通过高表达CXCL9、CXCL10和CXCL11招募巨噬细胞,并通过高表达HLA-DR和HLA-ABC捕获并活化CD103阳性细胞毒性T细胞。
③而被活化的T细胞又会激活巨噬细胞的炎症反应,促进中性粒细胞的招募和激活,介导血管生成,促进肿瘤的进展。
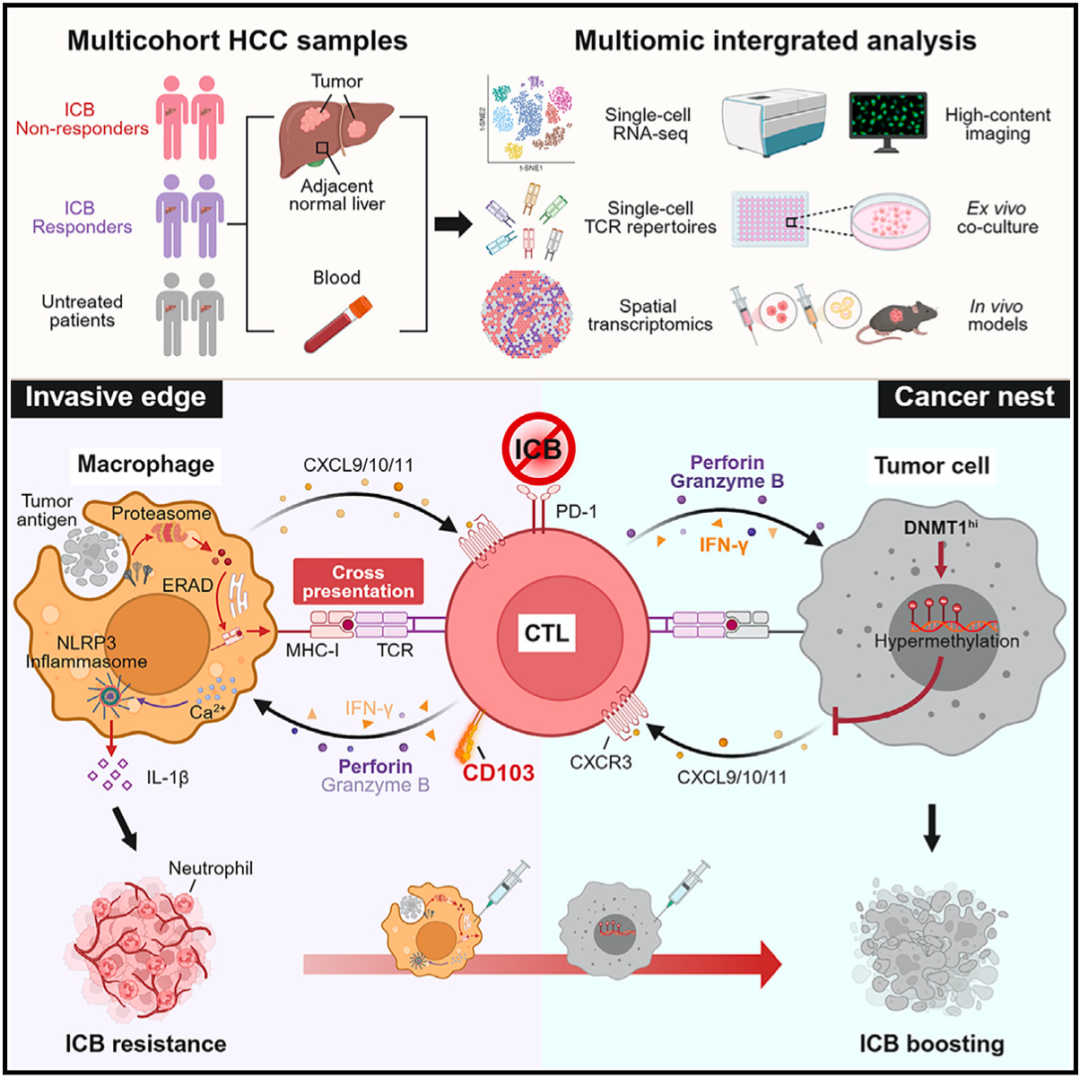
▲ 机制示意图
不难看出,肝癌确实是一个不折不扣的“操盘大师”,它可以通过一系列的“手段”将巨噬细胞、T细胞和中性粒细胞玩于股掌之上,甚至把兵临城下的肿瘤特异性细胞毒性T细胞都利用了。难怪肝癌如此难以攻破。
既然已经揭示了肝癌的手段,理论上就可以找到破解之法。邝栋明/魏瑗团队发现,阻断巨噬细胞介导的CD103阳性细胞毒性T细胞滞留,加上敲低Dnmt1诱导的瘤内CD103阳性细胞毒性T细胞招募,就可以最大限度地提高PD-L1抑制剂对肝癌小鼠模型的治疗效果。
总的来说,这个研究不仅揭示了肝癌发展的生物学过程,更重要的是找到了潜在破解之法。对于那些CD103阳性细胞毒性T细胞分布在瘤周的肝癌患者而言,重新分配CD103阳性细胞毒性T细胞的药物或许能提升免疫检查点抑制剂治疗肝癌的效果。
参考文献:
[1].Rumgay H, Arnold M, Ferlay J, et al. Global burden of primary liver cancer in 2020 and predictions to 2040. J Hepatol. 2022;77(6):1598-1606. doi:10.1016/j.jhep.2022.08.021
[2].Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries. Lancet Glob Health. 2018;6(5):e555-e567. doi:10.1016/S2214-109X(18)30127-X
[3].Wu L, Yan J, Bai Y, et al. An invasive zone in human liver cancer identified by Stereo-seq promotes hepatocyte-tumor cell crosstalk, local immunosuppression and tumor progression. Cell Res. 2023;33(8):585-603. doi:10.1038/s41422-023-00831-1
[4].Jeong JM, Choi SE, Shim YR, et al. CX 3 CR1 + macrophages interact with HSCs to promote HCC through CD8 + T-cell suppression. Hepatology. doi:10.1097/HEP.0000000000001021
[5].Wang H, Liang Y, Liu Z, et al. POSTN+ cancer-associated fibroblasts determine the efficacy of immunotherapy in hepatocellular carcinoma. J Immunother Cancer. 2024;12(7):e008721. doi:10.1136/jitc-2023-008721
[6].Huang et al. Pericancerous cross-presentation to cytotoxic T lymphocytes impairs immunotherapeutic efficacy in hepatocellular carcinoma. Cancer Cell. 2024. doi:10.1016/j.ccell.2024.10.012
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


