研究揭示全新α4整合素跨膜去活化蛋白LRP12调控细胞迁移
来源:网络 2023-07-11 08:59
本研究发现LRP12作为首个整合素去活化跨膜蛋白,通过其胞内结构域之间的相互作用结合到整合素α4亚基上,抑制paxillin-α4、talin-β亚基的结合,阻断整合素活化。
近日,《细胞报告》(Cell Reports)在线发表了中国科学院分子细胞科学卓越创新中心陈剑峰研究组撰写的题为LRP12 is an endogenous transmembrane inactivator of α4 integrins的研究论文。该研究揭示了LRP12是首个发现的内源性的整合素去活化跨膜受体蛋白,特异性调控α4整合素的活化及其介导的细胞迁移,并阐释了其对T细胞向肠道定向迁移和肠炎中的作用。
细胞黏附与迁移是基本的生命活动,参与机体发育、炎症反应、损伤修复和肿瘤转移等生理、病理过程。整合素(integrin)是由α和β两个亚基组成的跨膜细胞黏附分子,通过其胞外段与细胞外基质(ECM)和其他细胞表面的配体结合,双向传递跨膜信号,调控细胞黏附、增殖、骨架重排和凋亡等生理过程。整合素的多种生理功能依赖于其在活化状态与非活化状态之间的动态变化。这一过程是由细胞内调节蛋白结合到整合素胞内结构域所实现的。整合素活化异常可导致多种自身免疫病及肿瘤转移,因而调节整合素活化状态是近年来临床治疗和药物研发的关键。越来越多的证据表明,整合素去活化蛋白通过维持整合素活化-非活化之间的平衡,对整合素的功能起着重要作用。然而,目前对整合素去活化机制的认识较为有限。
本研究发现LRP12作为首个整合素去活化跨膜蛋白,通过其胞内结构域之间的相互作用结合到整合素α4亚基上,抑制paxillin-α4、talin-β亚基的结合,阻断整合素活化。LRP12-α4的相互作用在迁移细胞前端促进新生黏着斑解聚,并通过维持新生黏着斑动态平衡调控细胞迁移,最终介导T细胞稳定迁移,维持肠道稳态。
研究工作得到国家自然科学基金委员会、科学技术部等的支持。上海市第十人民医院的科研人员参与研究。
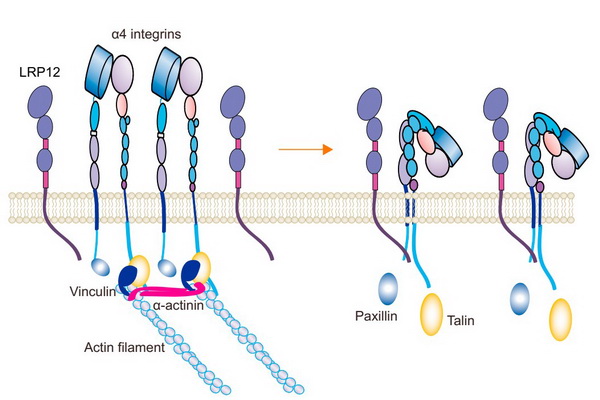
α4整合素跨膜去活化蛋白LRP12调控细胞迁移
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


