《科学》子刊:全球γδ T细胞抗体药物临床数据发布,新的免疫疗法即将诞生
来源:奇点糕 2021-11-18 07:56
提起肿瘤免疫治疗,名气最响的莫过于免疫检查点抑制剂(ICB)治疗了,目前抗PD-1/PD-L1/CTLA-4抗体的各类免疫治疗层出不穷,本质上来说,它们都是希望能够激活肿瘤组织中处于“耗竭”状态的CD8+T细胞,从而提高免疫细胞对肿瘤的杀伤效应。然而,现实总是骨感的,目前ICB免疫治疗在很多肿瘤中的效果仍差强人意,这也促使科学家们不断寻找其他免疫
提起肿瘤免疫治疗,名气最响的莫过于免疫检查点抑制剂(ICB)治疗了,目前抗PD-1/PD-L1/CTLA-4抗体的各类免疫治疗层出不穷,本质上来说,它们都是希望能够激活肿瘤组织中处于“耗竭”状态的CD8+T细胞,从而提高免疫细胞对肿瘤的杀伤效应。
然而,现实总是骨感的,目前ICB免疫治疗在很多肿瘤中的效果仍差强人意,这也促使科学家们不断寻找其他免疫细胞相关的治疗靶点。
其中,γδT细胞是一类特殊的免疫细胞,在固有免疫和适应性免疫中均发挥一定的功能,同时在肿瘤发生发展中也起着重要的免疫监视作用[1]。而Vγ9Vδ2T细胞是人类及其他灵长类动物外周血中γδT细胞的主要亚型[2],基于此,Vγ9Vδ2T细胞在抗肿瘤免疫过程中的作用也逐渐引起科学家们的关注。
近日,来自法国Imcheck研究所的Aude De Gassart教授团队,在《科学转化医学》上发表了最新研究成果,他们研发了一种新型的人源化抗嗜乳脂蛋白3A(BTN3A)单克隆抗体ICT01,该抗体可特异性地激活Vγ9Vδ2T细胞,进而对多种肿瘤细胞产生杀伤作用。此外,研究也公布了关于ICT01的首个1/2a期临床研究的初步数据,揭示ICT01在进展期肿瘤中患者治疗中的潜在临床价值[3]。
以往研究已经证实了γδT细胞在肿瘤免疫中的重要地位,有大规模临床研究显示γδ肿瘤浸润淋巴细胞(γδ TILs)是改善肿瘤总生存期(OS)及预后最重要的淋巴细胞亚群,甚至超过了CD8+ T细胞[4]。而科学家们对针对Vγ9Vδ2T细胞的肿瘤免疫疗法也进行了不断探索,但目前的一些研究成果在临床治疗中的效果仍不理想。基于此,研究者们针对Vγ9Vδ2T细胞的免疫治疗开展了进一步研究。
在细菌或病毒刺激细胞及细胞恶变过程中,细胞内磷酸化抗原(pAgs)会逐渐累积,而pAgs可通过与BTN3A相结合而激活Vγ9Vδ2T细胞,发挥免疫杀伤作用[5]。BTN3A属于B7家族中的一类质膜受体,目前在灵长类动物中发现共表达3种同型异构体(BTN3A1、BTN3A2 和 BTN3A3),而在啮齿类动物中不表达。
前期研究已开发了多种BTN3A抗体,如鼠源性抗体7.2及20.1等,可特异性激活Vγ9Vδ2T细胞,从而识别并清除多种肿瘤细胞[5, 6]。研究者们在此基础上受到启发,开发出了一种新型的人源化抗 BTN3A 单克隆抗体,即ICT01。
ICT01的可变区由鼠源性抗体7.2的亲本克隆改造而来,可识别BTN3A1的IgV结构域上远膜端的一个抗原表位,该表位包括了抗体20.1的结合位点(图1A)。研究者通过表面等离子体共振(SPR)及生物层干涉测量法(BLI)证实了ICT01对BTN3A的高度亲和力,ELISA实验表明ICT01对Daudi肿瘤细胞的中位有效浓度(EC50)为2.77 μg/ml(图1B-C)。此外,ICT01可与BTN3A的3种同型异构体均发生特异性结合,且结合程度呈浓度依赖性(图1D)。
随后,研究者以ICT01干预Daudi细胞后,发现ICT01可诱导Vγ9Vδ2T细胞脱颗粒,且该过程呈浓度依赖性(EC50为0.1μg/ml)(图2A),而BTN3A的游离受体百分比与Vγ9Vδ2T细胞脱颗粒的比例也呈明显相关(图2B-C),提示ICT01通过结合BTN3A受体而激活Vγ9Vδ2T细胞的功能。此外,研究者们通过基因敲除及转染等技术,证实ICT01通过结合BTN3A/BTN2A而激活Vγ9Vδ2T细胞,且不依赖于pAgs的B30.2结构域。
接下来,研究者们从健康受试者的血液中提取外周血单个核细胞(PBMCs),再予以ICT01干预,检测其对免疫细胞、细胞因子及驱化分子的影响。结果发现ICT01可浓度依赖性地上调CD69+Vγ9Vδ2T细胞占比(图2D),而对CD4+及CD8+ αβT细胞、 NK细胞、单核细胞均无影响。此外,ICT01干预48小时后,PBMCs上清中的IFNγ及TNFα均明显升高(P<0.001),此外IL-8、IL-1β、MCP-1也有所升高(P<0.05)(图2E)。以上表明ICT01可特异性激活Vγ9Vδ2T细胞,并促进促炎细胞因子的产生。
随后,研究者们进一步探究ICT01激活的Vγ9Vδ2T细胞对肿瘤细胞的杀伤能力。在包含白血病细胞HL60在内的14种不同肿瘤细胞的体外实验中,均证实了ICT01干预后,Vγ9Vδ2T细胞的激活可形成对肿瘤细胞强大的杀伤能力,且该杀伤过程依赖于BTN3A的表达(图3A-B)。此外,在大肠癌类器官3D模型中,ICT01诱导的Vγ9Vδ2T细胞对肿瘤细胞的杀伤作用同样显着(图3E-F)。
而以ICT01干预非肿瘤性人类脐静脉内皮细胞(HUVEC)时,尽管检测到了Vγ9Vδ2T细胞的数量增加,但HUVEC细胞的存活率并未受到影响,表明ICT01诱导的Vγ9Vδ2T细胞的活化可特异性杀伤肿瘤细胞,而对正常细胞的存活无明显影响(图3G)。
接下来,研究者还构建了NSG小鼠移植瘤模型,进一步证实ICT01通过激活Vγ9Vδ2T细胞发挥抑瘤作用。与对照组小鼠相比,γ9δ2T细胞+ICT01组小鼠的肿瘤生长明显减慢,且中位生存期由39天延长至42天(P<0.001)(图4)。
作为一种全新的人源性单克隆抗体,ICT01在临床中应用的安全性及耐受性也得到了证实。在开展临床研究之前,研究者在非人灵长类动物体内开展一系列研究,在每周予以0-100mg/kg剂量ICT01的各个干预组中,均未观察到ICT01导致的动物死亡及其他不良反应。
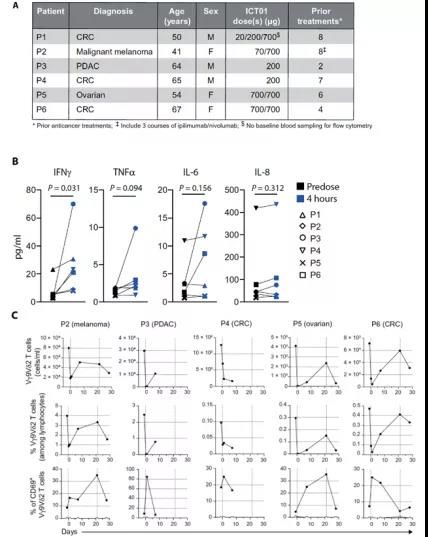
最后,研究者们公布了首个1/2a期临床研究(EVICTION: NCT04243499)的数据,研究初期共纳入了6名不同类型的进展期实体瘤患者,每3周分别予以20-700μg的ICT01干预(图5A)。在ICT01干预4小时后,研究者在患者的血清中检测到IFNγ及TNFα存在一定程度的升高,与前期体外实验结果相符(图5B)。此外,ICT01干预后,患者血清中的Vγ9Vδ2T细胞的含量及百分比有一过性降低,而在治疗后7~21天又可逐渐恢复至基线水平,提示ICT01可能驱动了Vγ9Vδ2T细胞自外周血至肿瘤组织的富集(图5C)。这一临床研究初步证实了ICT01在肿瘤患者中的潜在免疫治疗价值。
综上,研究者们研发了一种全新的人源性抗BTN3A抗体ICT01,可特异性增强Vγ9Vδ2T细胞对多种肿瘤的杀伤作用。ICT01能够以亚纳摩尔级别的亲和力和高度特异性与BTN3A 的3种同型异构体相结合,且不依赖于B30.2结构域。此外,动物实验及临床研究均在一定程度上证实了ICT01的安全性及有效性。总之,关于ICT01的研究成果目前仍是令人振奋的,其在抗肿瘤免疫治疗中的作价值还需要有更大规模的临床研究加以证实。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


