《细胞发现》:分析近10万个细胞,复旦附属中山医院团队发现了肝癌免疫逃逸新机制!
来源:奇点糕 2023-03-27 11:21
该研究通过对HCC单细胞水平转录组的研究,发现了一种与免疫抑制性微环境相关的癌相关成纤维细胞亚群,并确定了其介导肿瘤细胞免疫逃避的机制。同时,该研究还提出了一种可有效提高HCC免疫抑制剂疗效的辅助治疗
肝细胞癌(HCC)作为全球第六大常见癌症类型,由于通常其确诊时间较晚,每年会导致近83万的死亡[1]。
针对晚期肝癌的治疗,当前主流手段包括多激酶抑制剂索拉菲尼、仑伐替尼等的使用。随着具有里程碑意义的IMbrave150临床试验结果的发表,免疫检查点抑制剂正逐步改变晚期肝癌的治疗方式[2]。
但是与黑色素瘤、微卫星不稳定型肿瘤相比,肝癌对免疫检查点抑制剂响应率较低。因此,了解肝癌免疫疗法的耐药机制,以及开发针对肝癌更有效的免疫治疗策略,是当前肝癌治疗领域一大研究重点。
近日,由复旦大学附属中山医院史颖弘、樊嘉和刘卫仁领衔的研究团队,在著名期刊Cell Discovery上发表重要研究成果[3]。
他们发现,肝癌组织中的CD36+癌相关成纤维细胞(CAFs),可以通过分泌巨噬细胞迁移抑制因子(MIF),募集CD33+髓源性抑制细胞(MDSCs),为肝癌细胞提供抑制性的免疫微环境,使之逃过免疫系统的监视。而CD36抑制剂(SSO)和PD-1抑制剂的联合使用,可以恢复抗肿瘤T细胞反应,抑制肝癌的发展。
该研究揭示了HCC免疫疗法耐药新机制,为提高HCC免疫疗法的治疗效果提供了新思路。

论文首页截图
HCC肿瘤微环境的一大标志性特征是具有大量的CAFs。
这类细胞可以通过分泌多种细胞因子、趋化因子以及生长因子,直接或者间接的促进癌细胞的免疫逃避和肿瘤发展。许多研究已经表明,不同CAFs亚群可以通过与癌细胞相互作用,促进癌症发展[4]。
但是,目前人们对HCC中CAFs的异质性,特别是单细胞层面这些细胞与癌细胞的相互作用,仍然知之甚少。
鉴于此,研究人员利用单细胞测序手段,对来自7位HBV相关HCC患者的肿瘤组织和邻近正常肝组织的90572个细胞进行了转录组分析。根据标志基因ACTA2、COL1A1和COL1A2的表达,研究人员得到了1835个CAFs。
进一步聚类分析显示,这些CAFs可以被分为5个亚群。根据这些亚群GO和KEGG富集分析的结果,研究人员将它们分别命名为:血管相关CAFs(vCAFs)、基质相关CAFs(mCAFs)、脂质代谢-基质相关CAFs(lpmCAFs)、脂质代谢相关CAFs(lpCAFs)和抗原呈递相关CAFs(apCAFs)。
这些CAFs亚群在模拟人HCC遗传背景的CTNNB1N90;Trp53KO HCC小鼠模型中也存在。
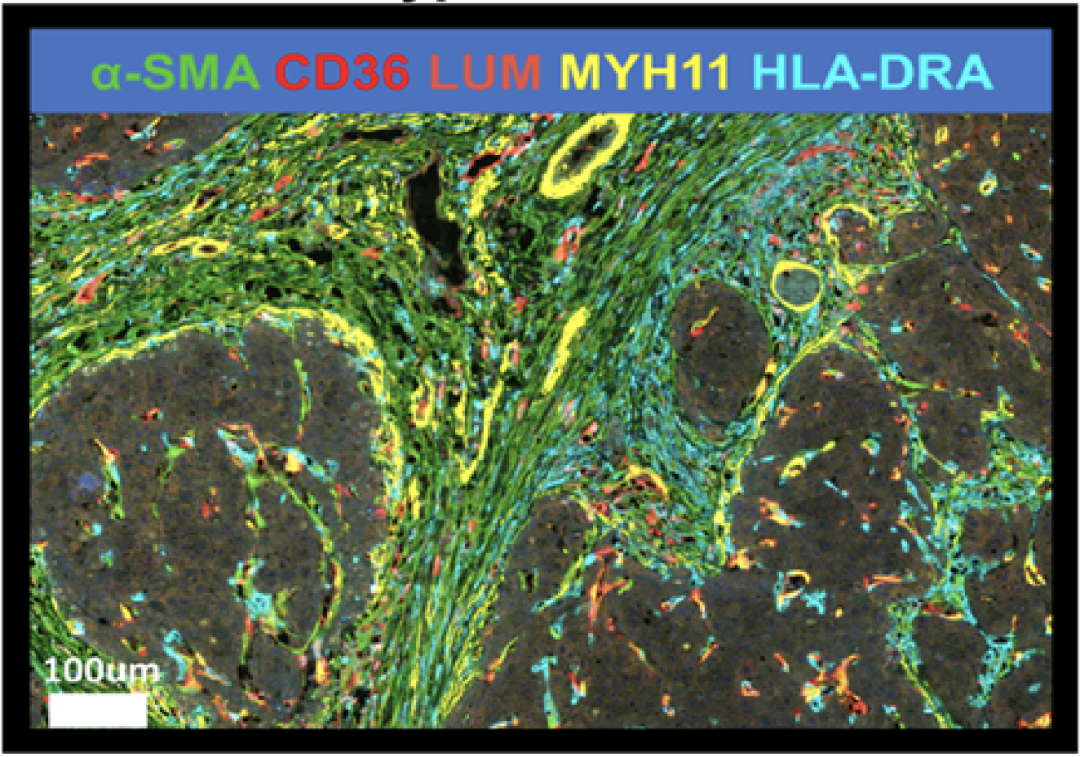
HCC肿瘤微环境存在多种CAFs亚型
为了了解不同细胞类型之间的联系,研究人员对包括癌细胞、T细胞、B细胞、MDSCs以及CAFs等9种细胞类型,进行了配体受体互作分析。
结果显示,CAFs与免疫微环境中包括MDSC等多种免疫细胞之间,都存在着由MIF和CD74/CXCR4介导的相互作用。进一步分析显示,MIF配体主要来源于lpmCAFs和lpCAFs这两个亚群。有意思的是,这两个亚群都高表达CD36。
多重荧光免疫组化结果显示,这些CD36+CAFs只在肿瘤组织中有浸润,在邻近正常肝组织中并不存在。
另外,单细胞数据结果显示,CD36+CAFs的细胞丰度与MDSCs的细胞丰度呈正相关,与效应T细胞的细胞丰度呈负相关。这意味着CD36+CAFs可能具有免疫抑制作用。
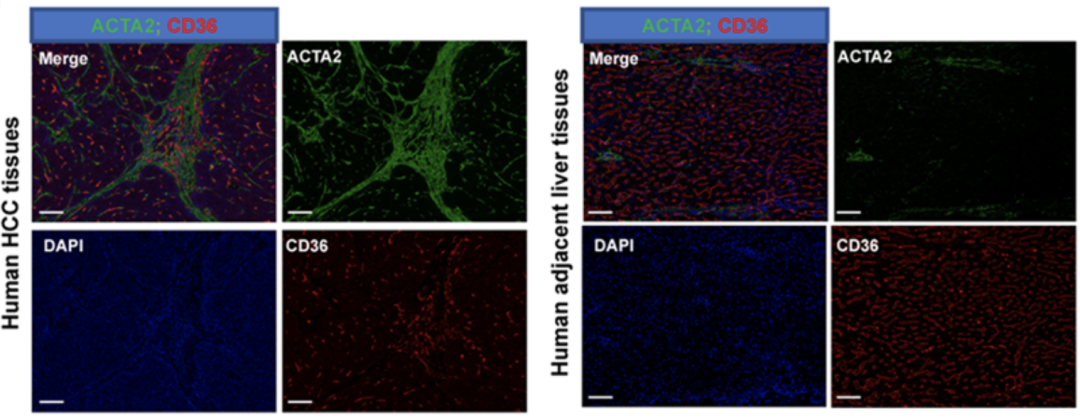
CD36+CAFs特异性浸润在肿瘤组织中,且其细胞丰度与抑制性的免疫微环境相关
为了弄清楚CD36+CAFs以及MIF在HCC发展过程中扮演的角色,研究人员分离出了小鼠HCC组织中CD36+CAFs,并比较了敲低CD36前后CAFs转录组和功能的变化。
结果显示,敲低CD36后,该CAF亚群中MIF的表达、分泌水平下降,且脂质过氧化功能及相关基因的表达下降,对氧化低密度脂蛋白(OxLDL)的吸收能力下降。
进一步分析显示,CD36+CAFs可以通过吸收OxLDL增强脂质过氧化功能,进而激活p38-CEBP信号通路,最终上调MIF的表达。
MIF在肿瘤微环境中的作用已有报道,包括促进免疫抑制性单核细胞样MDSCs的富集[5]。因此,研究人员分析比较了CD36+CAFs、CD36-CAFs、CD36kdCAF的调节培养基,对MDSC增殖分化过程的影响。
结果显示,CD36+CAFs调节培养基可以诱导CD33+MDSCs的扩增,效果与添加了MIF的培养基类似。而在CD36+CAFs调节培养基中添加MIF抑制剂,或者使用CD74抗体阻断MIF-CD74相互作用,可以抑制CD33+MDSCs的扩增。
进一步体内实验结果显示,相较于肝脏原位共同注射了HCC细胞和CD36-CAFs的小鼠,共同注射了CD36+CAFs的小鼠肿瘤发展明显加快,其微环境中CD8+效应T细胞明显减少,而敲低CD36、使用MIF抑制剂或者使用抗体清除MDSC,均可以逆转这些变化。这些结果说明,CD36+CAFs可以通过分泌MIF来促进MDSCs的增殖,进而营造一个利于肿瘤发展的抑制性免疫微环境。
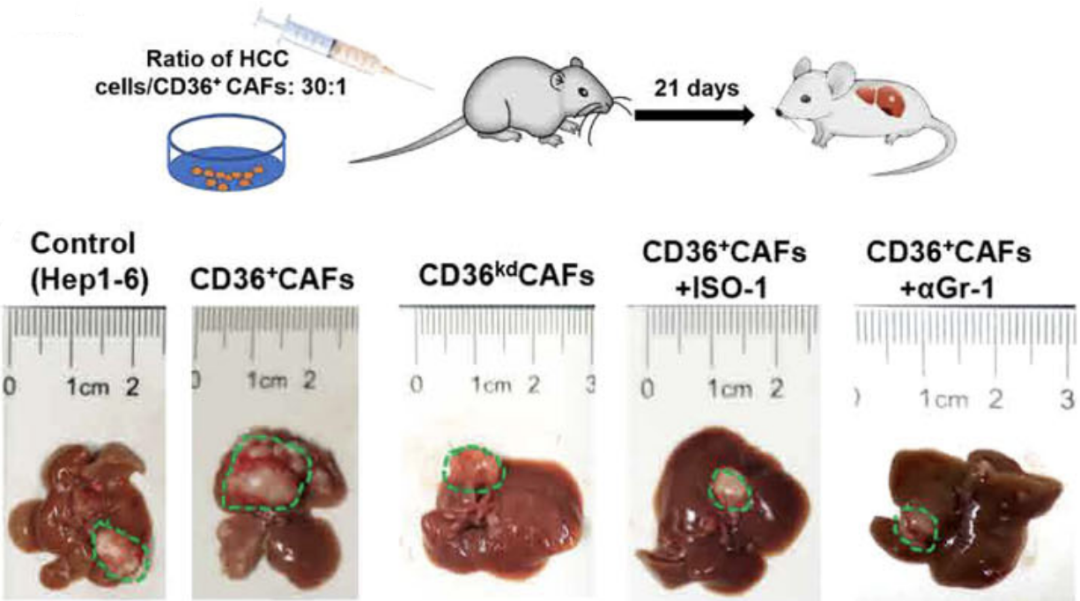
CD36+CAFs来源的MIF通过促进MDSC扩增来营造抑制性的免疫微环境
另外,研究人员还发现,CD36+CAFs可以诱导MDSC增强肿瘤细胞的干性,并且该作用可能是通过IL-6-STAT3通路实现的。
CD36+CAFs在HCC的发生及对免疫疗法的响应过程中同样扮演重要角色。研究人员发现,对比正常小鼠,成纤维细胞中敲除了Cd36或者Mif基因的小鼠,在尾静脉注射实验中形成了更少数量的肿瘤,且具有更长的生存期。
而且联合使用CD36抑制剂(SSO)和PD-1抑制剂,可以有效减少肿瘤微环境中Treg和MDSCs的丰度,增加CD8+效应T细胞丰度,控制肿瘤发展,显著改善小鼠生存期。
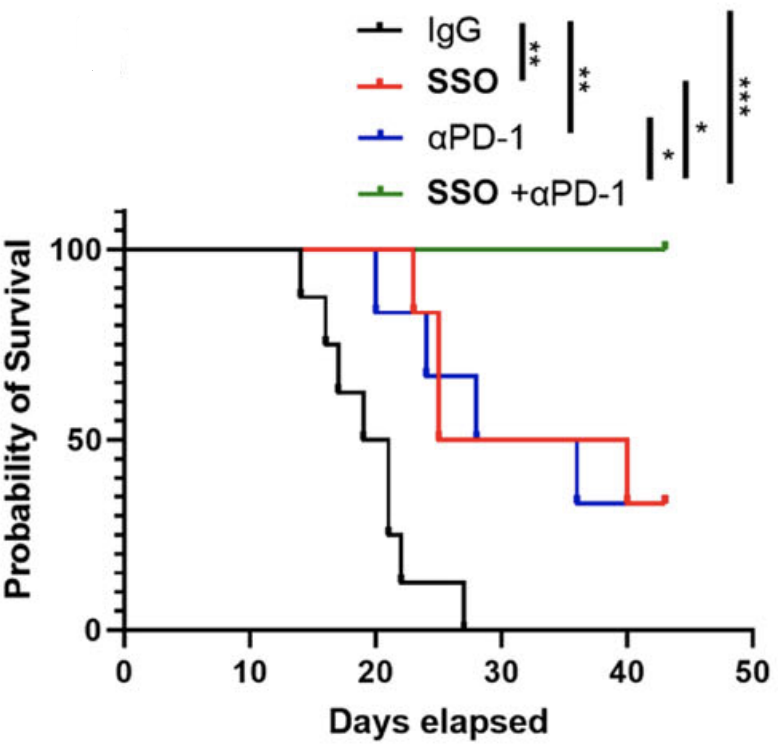
抑制CD36/MIF能提高PD-1抑制剂的抗肿瘤效果
总的来看,该研究通过对HCC单细胞水平转录组的研究,发现了一种与免疫抑制性微环境相关的癌相关成纤维细胞亚群,并确定了其介导肿瘤细胞免疫逃避的机制。同时,该研究还提出了一种可有效提高HCC免疫抑制剂疗效的辅助治疗思路,即通过靶向CD36来逆转抑制性的肿瘤免疫微环境。
参考文献:
[1] Sung, Hyuna, et al. "Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries." CA: a cancer journal for clinicians 71.3 (2021): 209-249.
[2] Yang, Chen, et al. "Evolving therapeutic landscape of advanced hepatocellular carcinoma." Nature Reviews Gastroenterology & Hepatology (2022): 1-20.
[3] Zhu, Gui-Qi, et al. "CD36+ cancer-associated fibroblasts provide immunosuppressive microenvironment for hepatocellular carcinoma via secretion of macrophage migration inhibitory factor." Cell Discovery 9.1 (2023): 25.
[4] Liu, Tongyan, et al. "Cancer-associated fibroblasts: an emerging target of anti-cancer immunotherapy." Journal of hematology & oncology 12.1 (2019): 1-15.
[5] Noe, Jordan T., and Robert A. Mitchell. "MIF-dependent control of tumor immunity." Frontiers in immunology 11 (2020): 609948.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


